
4. Топология атомов
О том, что микромир конкретен и прост по своему устройству, говорил еще великий Михаил Васильевич Ломоносов; в его научных трудах сквозит ясность и убедительность. Уже в то время он развил и обосновал учение о материальных атомах и корпускулах (молекулах и иных малых частицах); он представлял атомы как неделимые и способные к движению и взаимодействию: “Нечувствительные /материальные/ частицы должны различаться массою, фигурою, движением, силою инерции или расположением”. Это он заложил основы физической химии, превращающей ее из описательной науки в точную. “Физическая химия, — говорил он, — есть наука, объясняющая на основании положений и опытов физики то, что происходит в смешанных телах при химических операциях”. В 1752-1753 гг. М. В. Ломоносов впервые читал для студентов курс “Введение в истинную физическую химию”.
Одним из шагов к конкретизации устройства микромира была разработка теории пространственного строения химических соединений — так называемой стереохимии; она касалась не только органических веществ, но и неорганических, то есть координационных соединений. В частности, стереохимия изучает пространственную изомерию: изомеры имеют одинаковый состав молекул и одинаковое химическое строение, но отличаются друг от друга расположением атомов в пространстве. Продолжением стереохимии стала топология — совсем уж конкретное описание форм молекул вплоть до их математического выражения.
Поставим перед собой задачу определить формы уже не молекул, а отдельных атомов, то есть займемся их топологией, зная в общих чертах, что атом представляет собой естественно скрученную торовую оболочку (микрозавихрение) из эфира. Но прежде окинем взором все многообразие атомарного мира, известного теперь как таблица Менделеева.
В коре нашей планеты обнаружены атомы с атомным весом от 1 (водород) до 238 (уран); искусственно получено несколько их разновидностей с весом до 272; но меньше водорода атомов не существует. Первоначально считалось, что атомы не похожи друг на друга, и каждый химический элемент существует сам по себе. Таких якобы непохожих элементов на Земле — 88; все они представлены в таблице Менделеева со своими именами, со своими атомными весами и со своими химическими характеристиками.
Однако более внимательное изучение микромира привело к признанию существования большого количества похожих элементов с отличающимися атомными весами; их назвали изотопами. Уже обнаружено около 1850 таких разновидностей; из них примерно 280 — стабильные изотопы, а 46 — природные радиоактивные в семействах тория-232, урана-238 и урана-235. Число изотопов с каждым днем все увеличивается, и можно даже предположить, что при более тонкой сортировке атомов по их атомным весам это число будет почти что неограниченно возрастать. И все же, несмотря на кажущуюся возникшую запутанность в атомном мире, по-прежнему незыблемой остается сама таблица Менделеева, как система химических элементов; в основе которой — периодический закон Д. И. Менделеева.
Датой открытия закона считается 1 марта (17 февраля по Православному календарю) 1869 года, когда Дмитрий Иванович завершил работу “Опыт системы элементов, основанной на их атомном весе и химическом сходстве”; термин “периодический закон” (“закон периодичности”) ученый впервые употребил в конце 1870 года. Его формулировка закона гласит: “Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса”. (Более поздние корректировки формулировок закона, привязывающим его к неким зарядам неких ядер, согласно эфирной теории, не состоятельны и нами в расчет приниматься не будут.)
Принципом построения периодической системы является ее подразделение на группы и периоды; группы, в свою очередь, делятся на главные и побочные подгруппы: в каждой подгруппе — химические аналоги. Элементы подгрупп в большинстве групп обнаруживают между собой определенное сходство, главным образом в высших степенях окисления, которые чаще всего равны номеру группы. Период охватывает элементы, начиная со щелочных металлов и заканчивая инертным газом (исключение составляет первый период). Периодическая система состоит из семи периодов и восьми групп. Последний седьмой период в земных условиях не завершен, и нет никаких принципиальных ограничений на существование восьмого и последующих периодов.
В первый период включают водород и гелий; собственно даже это и не период, а отдельно стоящие элементы. А если исключить из него гелий и сместить его в начало следующего периода, как требует того эфирная теория (в этом мы убедимся чуть позже), то в первом периоде останется один только водород, место которому не находится нив одной из групп системы. Он проявляет свойства, общие со щелочными металлами и с галогенами.
Второй период, самый, пожалуй, интересный из всех; он начинается с лития и заканчивается инертным газом неоном; всего в него входят 8 элементов. Атом щелочного металла лития присоединяет исключительно только один атом кислорода, а атом следующего за ним бериллия — уже два. Далее следует бор, слабо проявляющий металлические свойства; его степень окисления +3. (Степень окисления определяет размер присоединения, а ее знак — перераспределение электронов при таком присоединении: положительный, когда атом теряет электроны, а отрицательный, когда забирает к себе.) Следующий за бором углерод — типичный неметалл, степень окисления которого бывает как +4, так и –4. Азот, кислород и фтор — все неметаллы; у азота высшая степень окисления +5, и соответствует она номеру группы. Кислород и фтор относятся к самым активным неметаллам.
Третий период (натрий … аргон) также содержит 8 элементов; характер изменения их свойств в основном подобен тому, что наблюдается во втором периоде. Особенности состоят в том, что магний, в отличие от бериллия, более металличен, как и алюминий по сравнению с бором. Кремний, фосфор, сера, хлор — типичные неметаллы; они проявляют высшие степени окисления, равные номеру группы.
Менделеев называл элементы второго и третьего периодов (по его словам — малых) типическими. Эти элементы — самые распространенные в природе; углерод, азот и кислород, как и водород, являются основными элементами органической и живой материи.
В четвертом периоде насчитывается уже 18 элементов, начиная со щелочного металла калия и кончая инертным газом криптоном. За калием следует щелочноземельный металл кальций, а далее следует ряд из десяти переходных металлов: скандий … цинк; большинство из них, кроме железа, кобальта и никеля, проявляют высшие степени окисления, равные номеру группы.
Пятый период (рубидий … ксенон) аналогичен четвертому; в обоих этих периодах особенности изменения свойств элементов по сравнению со вторым и третьим периодами — более сложные. Шестой период (цезий … радон) включает 32 элемента; в нем, кроме переходных металлов (лантан, гафний … ртуть), располагаются лантаноиды (церий … лютеций), причисляемые к редкоземельным элементам. Седьмой период — все прочие элементы, начиная с франция.
Разделение элементов на группы и подгруппы вызвано ярко выраженным изменением химических свойств внутри периодов. Например, у химических элементов второго и третьего периода от лития до неона и от натрия до аргона с возрастанием атомной массы свойства изменяются следующим образом:
Отдавая должное периодическому закону химических элементов и отмечая его системность, нельзя в то же время не упомянуть о том, что он далеко не идеален, и не потому, что ученые не до конца раскрыли его секреты, а по своей природе. Бросается в глаза такое исключение из закона: калий, имеющий меньшую атомную массу, чем аргон, должен был бы занимать место в периодической таблице перед ним; но он — щелочной металл, и его пришлось расположить после аргона. Таких перестановок в таблице оказалось три. Или еще: высшая валентность элементов отдельной группы в соединениях с кислородом должна определяться номером этой группы; но медь, относящаяся к первой группе, проявляет, например, двойную валентность, а фтор из седьмой группы никогда не бывает семивалентным. Особенно бросается в глаза нестабильность валентности: у некоторых элементов она может быть двойной, тройной и даже большей.
Будем надеяться, что выявление конфигурации атомов, производимое на основе эфирной теории и обозначенное нами как топология атомов, позволит объяснить и закономерности периодического закона и его исключения. В математике топология изучает свойства фигур, не изменяющиеся при деформациях, производимых без разрывов и склеиваний (математики говорят: при взаимно однозначных и непрерывных отображениях). В нашем случае топология будет определять варианты скручивания торовых оболочек, и точно также: без разрывов и склеиваний в прямом смысле.
4.1. Водород
Водород — бесцветный газ, сжижающийся лишь при очень глубоком холоде. Он — самый легкий из всех газов; плотность водорода в 14,5 раз меньше плотности воздуха; поэтому наполненные водородом шарики устремляются в небо.
В химическом плане водород — чрезвычайно активное вещество: он соединяется с очень многими химическими элементами, если не сказать, что со всеми. Он первым стоит в таблице Менделеева, и его атомная масса равна 1,0079.
После общих физических и химических характеристик (более подробно о них мы будем говорить дальше) посмотрим на водород с позиции эфирной теории; нас интересует конфигурация его атома — его топология.
О том, что атом водорода представляет собой тор с вращающейся оболочкой, мы уже знаем. Шнур тора состоит как бы из соосно собранных электронов, а электрон представляет собой бегающие по кругу друг за другом три эфирных шарика. Значит, в сечении шнура тора — три таких шарика.А сколько шариков во всем атоме водорода? Подсчитать не трудно: из физики нам известно, что атом водорода в 1840 раз тяжелее электрона, а в электроне — три шарика; значит, всего — 5520 шариков. Правда, в той же физике иногда указывается, что атом водорода тяжелее электрона всего лишь в 1863 раз; и тогда в нем будет уже 5508 эфирных шариков. Но встречается и такое: электрон легче протона (ядра атома водорода) в 2000 раз; значит, — не 5520 и не 5508, а 6000 шариков (?).
Комментируя эти расхождения, можно было бы сослаться на неточность физических опытов и вычислений: дескать, 2000 — при грубом округлении, 1840 — более точно, 1836 — совсем точно. Но, отталкиваясь от эфирной теории, мы теперь заявляем, что точны все три числа, и более того — действительный разброс инерции атома водорода намного шире. (Но при всей широте отклонений инерция конкретного атома может быть только строго кратной инерции электрона — так уж устроен шнур тора; а инерция электрона, в свою очередь, неизменна: это — три бегающих с постоянной скоростью шарика.)
У атома водорода есть минимальный размер, меньше которого он не может быть. Определяется этот наименьший размер тора упругостью шнура, а она, в свою очередь, — избыточной плотностью окружающего эфира. Каков он — этот размер? Трудно сказать, но, выбирая из упомянутых трех чисел, можно остановиться на минимальном, то есть на 1836; реально, конечно, это число еще меньше: может быть даже где то около 1800. Да это и не важно: тысяча восемьсот так тысяча восемьсот; остановимся на этом.
И вот, начиная с тысячи восьмисот, наверняка есть атомы с числом 1801, и с числом 1802, и с числом 1803, и так далее вплоть до … (?), но верхнего предела почти что нет: атом водорода может быть тяжелее электрона и в три тысячи раз, и в четыре, и в пять тысяч, и даже более, пока не превратится в атом гелия. Этим объясняется то, что у водорода обнаружены изотопы: протий, дейтерий, тритий с атомными весами1, 2 и 3. Только мы теперь заявляем, что их — изотопов водорода — в действительности не три, а более четырех тысяч; и то, что они оказались разбиты всего лишь на три указанных группы, говорит о грубости методов сортировки.
Внутренний диаметр наименьшего атома водорода — протия — можно определить, зная, что по окружности расположены 1800 эфирных шариков; следовательно, он приблизительно равен 570 диаметров шариков. (Здесь уместно отметить, что диаметр эфирного шарика, или просто — шарик, является абсолютной мерой длины.) Такой приблизительный расчет не учитывает два обстоятельства: во-первых, соседние шарики не выстраиваются в линию, а смещены друг относительно друга, то есть в своем вращении соседние строенные (электронные) шарики сдвинуты на некоторую фазу, а во-вторых, шарики на внутреннем диаметре тора сдеформированы. Обе эти поправки уменьшают действительный диаметр, поэтому будем считать, что число 570 как наиболее точное. В дальнейшем нас будет интересовать наименьший радиус изгиба шнура тела атомов, и он, следовательно, будет равен 285 эфирным шарикам.
Почему тор стремится принять форму овала, гантели, или даже восьмерки с перехлестом? Выше мы уже объясняли это; повторим: вращающаяся оболочка тора возмущает прилегающий к ней эфир, и больше — во внутреннем пространства, чем вовне; поэтому эфирное давление снаружи оказывается больше, чем внутри; разность давлений стремится сложить тор; и в противоборстве с упругостью шнура определяется окончательная его форма.

Противоборство сжимающей и упругой сил при отсутствии трения порождает неустойчивость формы; это — уже динамика. Даже идеально круглый атом протия не сохраняет свою круглую форму: он попеременно сжимается в овал то по одной оси, то по перпендикулярной к ней, то есть пульсирует. Овальный тор более крупного атома склонен прогибаться в гантель; гантель еще более крупного атома — в восьмерку, а восьмерка, в свою очередь, закручивается в перехлест; и поэтому каждый атом водорода находится в состоянии пульсации.
Динамика форм атомов усложняется еще и тем, что у вытянутых торов (у овала, у гантели и у восьмерки) края загибаются в стремлении сблизиться друг с другом. Кривизна такого поперечного загиба также определяется упругостью шнуров; минимальный радиус кривизны колеблется где-то около тех же 285 шариков: чуть меньше или чуть больше; такое колебание тоже представляется как пульсация. Следовательно, крупные атомы водорода пульсируют в разных направлениях и, естественно, с разными частотами; и чем крупнее атом, тем сложнее и энергичнее его колебания; этим можно объяснить то, что самые крупные атомы водорода (в районе трития) склонны к радиоактивности, то есть к распаду. Известно даже, что усредненное время полураспада трития составляет 12 лет.
Пульсирующие атомы водорода возбуждают вокруг себя эфир (стоячие тепловые поля), и это возбуждение делает их пушистыми, то есть обладающими способностью отталкиваться, не приближаясь вплотную, от других атомов. Пушистость делает атомы летучими, а в целом водород — газообразным. Соединение атомов водорода в молекулы не устраняет их пульсацию, и поэтому молекулярный водород (а он чаще именно таким и бывает) — тоже газообразен. Свои стоячие тепловые поля атом водорода теряет только в тех случаях, когда соединяется в молекулы с другими химическими элементами и когда его пульсация подавляется молекулярными связями.
Взятая нами на вооружение топология атомов позволяет объяснить физическую сторону валентности, то есть способности атомов соединяться друг с другом; в общих чертах мы об этом уже говорили. У атома водорода (у протия), то есть у тора с вращающейся оболочкой, одна из двух сторон — как бы присасывающая (она в самом деле присасывающая), и выглядит она как воронка, внутрь которой устремляется эфир; это и есть валентность атома: этой своей стороной, то есть этой присасывающей воронкой, атом готов прилипнуть (присосаться) к другим атомам. У протия присасывающая воронка — идеально круглая, но это — исключение: у всех других атомов она выглядит как петля, и даже у дейтерия и трития она больше похожа на петлю, чем на кольцеобразную воронку, а если говорить точнее, то, по крайней мере, у трития таких петель — уже почти две (у восьмерки — две петли); а если восьмерка — с перехлестом, то есть петли развернуты на 180 градусов, то тогда образуются две законченные петли с присасывающими воронками, расположенными с разных сторон.
Благодаря наличию у атомов водорода присасывающих воронок (валентности), они могут объединяться и объединяются в пары, то есть в молекулы. Очевидно, самое прочное соединение будет возникать в том случае, когда размеры атомов будут совпадать: протий с протием, дейтерий с дейтерием и так далее. Но по теории вероятности такие совпадения — маловероятны (еще раз в связи с этим напомним, что изотопов у водорода не
три, а более четырех тысяч); поэтому в общей своей массе молекулы водорода будут состоять из разнокалиберных атомов, прочность соединения которых — не столь высока. Она будет ослабляться еще и от того, что у спарившихся разнокалиберных атомов не будут совпадать частоты их пульсаций. Если даже предположить, что произошло почти невероятное: соединились абсолютно одинаковые по размерам два протия, то и тогда прочность их соединения не будет абсолютной: наверняка их пульсации будут смещены по фазе (даже — в противофазе), и это ослабит молекулу.Пользуясь моментом, выскажем предположение, что крупные атомы водорода (в районе дейтерия и, тем более, в районе трития) могут присоединять к себе по два мелких атома (протия).
У атомов водорода, как мы сказали, валентность выражается в наличии присасывающих воронок. У молекул эти воронки нейтрализованы, поэтому молекула водорода, как единое целое, казалось бы, нейтральна и к соединению с другими атомами не должна стремиться. Все так на самом деле и есть за исключением одного “но”: соединенные в пару приблизительно одинаковые по размерам атомы водорода образуют по контуру другую разновидность валентности — присасывающий желоб; с его помощью молекула водорода может присоединяться к другим атомам, имеющим подобную валентность, например к атомам металлов, создавая гидриды. Мешающая такому присоединению пульсация атомов водорода может быть в подобных случаях подавляться соседними атомами. С помощью присасывающих желобов молекулы водорода должны были бы соединяться и между собой, но мешают этому все те же стоячие тепловые поля, то есть пушистость молекул. Если же ее устранит, например замораживанием, то молекулы действительно начнут соединяться и создавать твердые тела, и эти тела будут обладать свойствами металлов: контурные присасывающие желоба их молекул будут образовывать непрерывные дорожки для электронов, а бугристые поверхности тел (у атомов водорода нет прямых участков) будут хорошо отражать свет и создавать характерный металлический блеск. Но для того, что бы “успокоить” атомы водорода, их нужно охладить до температуры минус 259,1 градуса Цельсия.
Подробнее о соединениях водорода с конкретными другими химическими элементами будем говорить при рассмотрении топологий атомов этих элементов.
4.2. Гелий
Гелий занимает вторую позицию в таблице Менделеева после водорода. Атомная масса гелия — 4,0026. Он представляет собой инертный газ без цвета. Его плотность — 0,178 грамм на литр. Сжижается гелий труднее всех известных газов лишь при температуре минус 268,93 градуса Цельсия и практически не отвердевает. Охлажденный до минус 270,98 градуса Цельсия гелий приобретает сверхтекучесть. Образуется гелий чаще всего в результате распада крупных атомов. На Земле он распространен в малых количествах, но на Солнце, где идет интенсивный распад атомов, гелия очень много. Все эти данные являются как бы паспортными и хорошо известны.
Займемся топологий гелия, и для начала определим его размеры. Учитывая, что атомная масса гелия в четыре раза больше водородной, а атом водорода в 1840 раз тяжелее электрона, получим массу атома гелия равной 7360 электронам; следовательно, общее количество эфирных шариков в атоме гелия составляет приблизительно 22 000; длина шнура атома и диаметр исходного тора соответственно равны 7360 и 2300 эфирным шарикам. Чтобы зримо представить соотношение толщины шнура исходного тора атома гелия и его диаметра, изобразим на листе бумаги ручкой окружность диаметром в 370 миллиметров, и пусть след от ручки имеет ширину в одну треть миллиметра; полученная окружность даст нам указанное представление. Один электрон (строенные эфирные шарики) будет занимать на нарисованной окружности всего лишь 0,15 миллиметров.
Скручивание исходного тора в законченную форму атома гелия происходит следующим образом. Сначала окружность сплющивается в овал, потом — в форму гантели, далее — в восьмерку, а затем петли восьмерки развертываются так, что возникает перехлест. Между прочим, перехлест у более крупных атомов не образуется, и объясняется это тем, что длина шнура у атома гелия пока еще не большая, и при стремлении средних точек шнура сблизиться — края (петли) вынуждены развернуться. Далее края изогнутся и начнут сближаться.
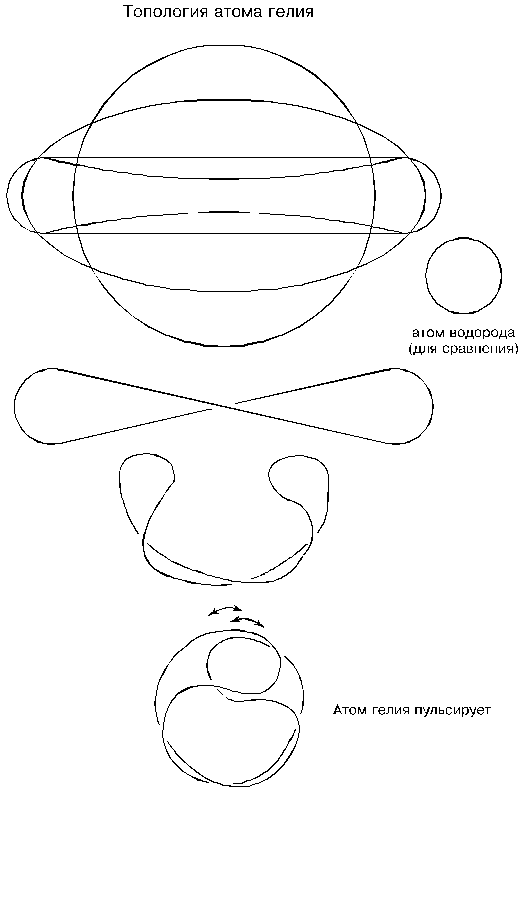
До этого момента топология атома гелия, как мы видим, схожа с топологией атома изотопа водорода — трития, но если у трития не хватало сил на замыкание краев (не хватало длины его шнура), то у гелия петли надвигаются одна на другую и таким образом замыкаются. Для того, чтобы убедиться в надежности соединения петель, достаточно проследить за расположением их присасывающих сторон: у внутренней петли она будет снаружи, а у внешней — изнутри.
Топологию атомов очень удобно представлять в виде проволочных моделей; для этого достаточно использовать в меру упругую, но достаточно пластичную проволоку. Атом водорода изобразится в виде обычного кольца. Увеличим длину куска проволоки в четыре раза (во столько раз атом гелия тяжелее атома водорода), свернем его в кольцо, спаяем концы и продемонстрируем процесс скручивания атома гелия. При скручивании мы должны постоянно помнить, что радиусы гибки не должны быть меньше радиуса кольца, представляющего собой атом водорода; это как бы условие, задаваемое упругостью шнура — торовых оболочек. (В натуре, напомним, минимальный радиус равнялся 285 эфирным шарикам.) Принятый минимальный радиус гибки определяет топологию всех атомов; и еще: следствием одинаковых радиусов гибки будут одинаковые размеры присасывающих петель (своего рода — их стандартизация), и поэтому-то они образуют устойчивую валентность, выраженную в способности соединять различные атомы между собой. Если бы петли имели различные размеры, их соединение было бы проблематичным.
Доводя процесс скручивания проволочной модели атома гелия до конца, мы обнаружим, что соединенные внахлест петли надвинуты одна на другую не до упора. Точнее говоря, они предпочли бы закрутиться еще дальше, но не пускает упругость шнура, то есть условие минимального радиуса. И при всякой попытке петель продвинуться навстречу еще дальше упругость шнура отбросит их назад; отскочив, они снова устремятся вперед, и снова упругость отбросит их назад; при этом атом гелия будет то съеживаться, то распускаться, то есть возникает пульсация. Пульсация, в свою очередь, породит стоячее тепловое поле вокруг атома и сделает его пушистым; так мы пришли к выводу, что гелий — газ.
На основании топологии можно объяснить и прочие физические и химические характеристики гелия. О его инертности, например, говорит то, что его атомов нет ни открытых присасывающих петель, ни присасывающих желобов: он не способен вообще соединяться с другими атомами, поэтому — всегда атомарен и практически не отвердевает. Цвета гелий не имеет потому, что у его атомов нет прямых “звучащих” участков шнуров; а сверхтекучесть у него возникает вследствие всякого отсутствия вязкости (слипание атомов), округлой формы и малого размера атома.
Как и у водорода, у гелия атомы не имеют одного размера: одни из них больше, другие — меньше, а в общем они занимают почти все весовое пространство от водорода (трития) до следующего за гелием лития; менее прочные изотопы гелия, конечно, давно уже распались, но и существующих в настоящее время можно насчитать не одну сотню.
В таблице Менделеева гелий лучше располагать не в конце первого периода — в одном ряду с водородом, а в начале второго периода перед литием, потому что его атом, как и атомы всего этого периода, представляет собой одиночную конструкцию (одиночный клубочек), в то время как атом следующего инертного газа неона выглядит уже в виде спаренной конструкции, похожей по этому признаку на атомы третьего периода.
4.3. Литий
Литий занимает третий номер в таблице Менделеева; его атомная масса равна 6,94; он относится к щелочным металлам. Литий — самый легкий из всех металлов: его плотность составляет 0,53 грамма в сантиметре кубическом. Он серебристо-белого цвета, с ярким металлическим блеском. Литий мягок и легко режется ножом. На воздухе он быстро тускнеет, соединяясь с кислородом. Температура плавления лития равна 180,5 градуса Цельсия. Известны изотопы лития с атомными весами 6 и 7. Первый изотоп используется для получения тяжелого изотопа водорода — трития; другой изотоп лития используется в качестве теплоносителя в котлах ядерных реакторов. Таковы общие физико-химические данные лития.
Топологию атомов лития начнем опять же с уяснения размеров исходного тора. Теперь мы знаем, что у каждого химического элемента, и в том числе у лития, существует большое количество изотопов, измеряемое сотнями и тысячами; поэтому размеры атомов будем указывать от … и до …. Но что значат эти пределы? Можно ли их определить точно? Или они указываются приблизительно? И каково количественное соотношение изотопов? Сразу скажем: однозначных ответов на поставленные вопросы нет; всякий раз необходимо внедряться в конкретную топологию атомов. Разберемся в этих вопросах на примере лития.
Как мы заметили, переход от протия к гелию с точки зрения топологии происходит планомерно: с увеличением размера исходного тора –постепенно изменяется окончательная конфигурация атомов. Но физические и, особенно, химические свойства атомов при переходе от протия к гелию изменяются более чем существенно, скорее — радикально: от всеобщей притягательности протия до полной инертности гелия. Где, на каком изотопе это произошло?
Подобные скачки свойств связаны с размерными скачками изотопов. Большой атом водорода (тритий), приобретающий очертания атома гелия, оказывается радиоактивным, то есть непрочным. Вызвано это тем, что его загнутые края петель не достигают друг друга, и можно представить, как они трепыхаются, устремленные навстречу. Они напоминают руки двух людей в расходящихся лодках, бессильно стремящихся дотянуться и сцепиться. Внешнее эфирное давление будет давить на консоли трепыхающихся петель атомов так сильно, что это до добра не доведет; получив со стороны даже небольшое дополнительное сдавливание, консоли отломятся — не выдержат крутого изгиба шнура, и атом разрушится; так оно и происходит. Поэтому можно сказать, что среди изотопов на границах существующих физико-химических переходов наблюдаются провалы: там изотопов просто нет.
Подобный провал существует между гелием и литием: если атом — уже не гелий, но еще не литий, то он непрочен, и его уже давно в земных условиях нет. Поэтому изотоп лития с атомным весом, равным шести, то есть с длиной шнура тора в 11 эфирных шариков, встречается очень редко и, как было сказано, используется для получения трития: его легко разорвать, укоротить и получить в результате изотоп водорода.
Таким образом, мы, вроде, определились с наименьшими размерами атома лития: это — 11 связанных электронов. Что же касается его верхнего предела, то тут возникает некоторая загвоздка: дело в том, что, согласно топологии, атом лития не имеет особых отличий от атома следующего за ним бериллия (мы в этом скоро убедимся), и между изотопами того и другого элементов нет никакого провала. Поэтому пока не станем указывать верхний предел размера атома лития.
Проследим за формообразованием атома лития. Исходная окружность только что возникшего микрозавихрения с указанными выше размерами будет стремится превратится в овал; только у лития овал — очень длинный: приблизительно в 8 раз длиннее диаметра концевого закругления (будущей петли); это — очень вытянутый овал. Начало свертывания атома лития похоже на такое же начало у больших атомов водорода и у гелия, но дальше происходит отклонение: восьмерка с перехлестом, то есть с разворотом петель, не возникает; дальнейшее сближение длинных сторон (шнуров) овала до полного их соприкосновения сопровождается одновременным загибом концов навстречу друг другу.
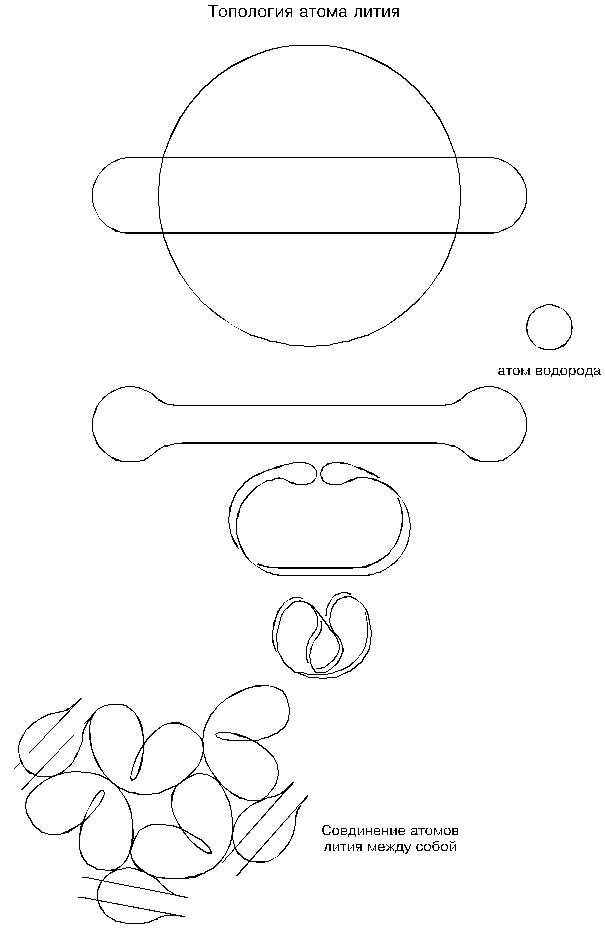
Почему не образуется восьмерка с перехлестом? Прежде всего потому, что овал очень длинный, и даже его полный прогиб в гантелю до соприкосновения шнуров в середине не вызывает их сильных изгибов; поэтому потенция разворота крайних петель — очень слабая. А во-вторых, развороту в какой-то степени противодействует начавшийся загиб концов овала. Другими словами: активный момент сил, стремящийся развернуть концевые петли, очень мал, а момент сопротивления развороту — большой.
Для наглядности воспользуемся резиновыми кольцами, например теми, что применяются в уплотнениях машин. Если пережимать кольцо малого диаметра, то оно обязательно свернется в восьмерку с перехлестом; а если выбрать кольцо большого диаметра, то его пережим до полного соприкосновения шнуров разворот концевых петель не вызывает. К слову: эти резиновые кольца также очень удобны для моделирования топологии атомов; если, конечно, имеется их широкий набор.
Загиб концов овала вызывается, как мы уже знаем, возмущением эфира между ними: чуть-чуть стронувшись с идеально прямого положения, они уже вынуждены будут сближаться до полного соприкосновения. Значит, в разные стороны концы отгибаться не могут. Но с направлением загиба у них есть выбор: либо так, что присасывающие стороны концевых петель окажутся снаружи, либо — изнутри. Первый вариант более вероятен, та как момент от сил отталкивания вращающихся оболочек шнура от прилегающего эфира на внешних точках петель будет больше, чем на внутренних.
Сближающиеся боковые стороны овала очень скоро войду в соприкосновение, смычка шнуров распространится от центра к концам и остановится только тогда, когда на концах окончательно сформируются петли с минимально допустимыми радиусами изгиба. Одновременно происходящие загибы и взаимное сближение этих петель приводят к столкновению их вершин, после чего в дело вступают их присасывающие стороны: петли, присасываясь, ныряют вглубь; и завершается процесс формирования конфигурации атома лития тем, что сместившиеся петли упираются своими вершинами в спаренные шнуры ровно по центру конструкции. Отдаленно такая конфигурация атома напоминает сердечко или, точнее, яблоко.
Напрашивается сам собой первый вывод: атом лития начинается тогда, когда вершины спарившихся первичных петель, нырнувшие внутрь конструкции, дотянутся до шнуров середины атома. А до того был еще не литий, а какой-то иной элемент, которого теперь уже нет в природе; его атом был крайне неустойчив, очень сильно пульсировал, был поэтому пушистым и относился к газам. Но и атом самого начального изотопа лития (мы его определили состоящим из 11 000 связанных электронов) тоже получается не очень прочным: радиусы изгиба его петель — предельные, то есть упругие шнуры изогнуты до предела, и при всяком внешнем воздействии они готовы лопнуть. У более крупных атомов это слабое место устраняется.
Представляя по результатам топологии образ атома лития, можно оценить то, что получилось. Две первичные петли замкнулись и нейтрализовались, также нейтрализованными оказались вторичные петли по обе стороны от первичных. Спаренные шнуры создали желоб, и этот желоб идет по всему контуру атома — он как бы замкнут в кольцо, — и его присасывающая сторона оказалась снаружи. Отсюда следует, что атомы лития могут соединяться и между собой и с другими атомами только с помощью своих присасывающих желобов; петлевое молекулярное соединение атом лития образовать не может.
Сильно выпуклые присасывающие желоба атомов лития могут соединяться между собой только на коротких участках (теоретически — в точках), и поэтому пространственная конструкция из соединившихся между собой атомов лития получается очень рыхлой и разреженной; отсюда — малая плотность лития: он почти в два раза легче воды.
Литий — металл; его металлические свойства вытекают из особенностей форм его атомов. Можно сказать по-другому: те особые свойства лития, которые обусловлены особыми формами его атомов и которые делают его непохожим физически и химически на другие вещества, названы металлическими; рассмотрим часть из них:
На примере отмеченных физических особенностей лития можно уточнить само понятие металла: металл есть вещество, состоящее из атомов с круто изогнутыми шнурами, образующими контурные присасывающие желоба, открытые наружу; атомы ярко выраженных (щелочных) металлов не имеют открытых присасывающих петель и прямых или плавно изогнутых участков шнуров. Поэтому литий в нормальных условиях не может соединиться с водородом, так как атом водорода представляет собой петлю. Их соединение может быть только гипотетическим: при глубоком холоде, когда водород отвердевает, его молекулы могут соединяться с атомами лития; но по всему видно, что их
сплав был бы таким же мягким, как сам литий.Заодно уточним понятие пластичности: пластичность металлов определяется тем, что их округлые атомы могут обкатываться друг по другу, изменяя взаиморасположение, но не теряя контакты между собой
.4.4. Бериллий
Бериллий занимает четвертую позицию в таблице Менделеева. Его атомная масса равна 9,012. Он представляет собой светло-серый металл с плотностью 1,848 грамма в кубическом сантиметре и температурой плавления 1284 градуса Цельсия; он — твердый и в то же время
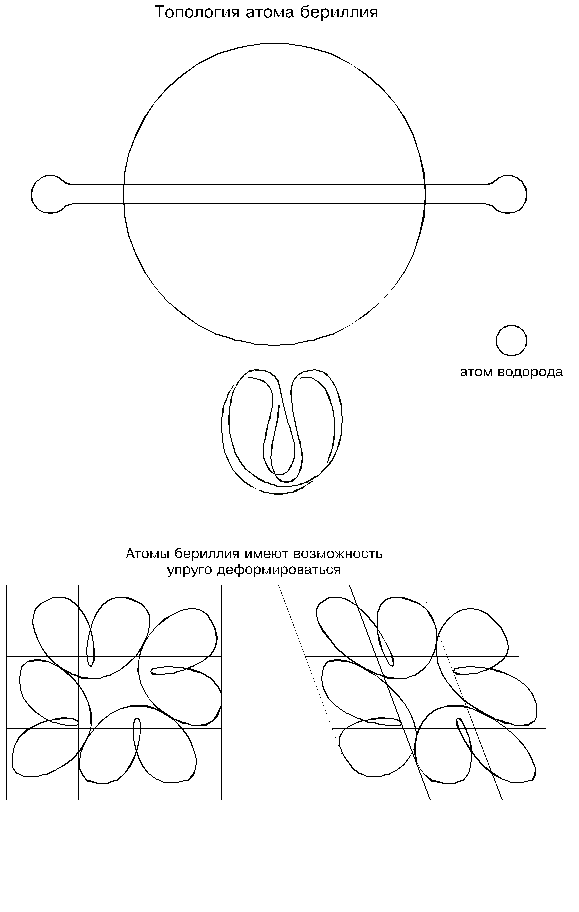
хрупкий. Конструкционные материалы на основе бериллия обладают одновременно и легкостью, и прочностью, и стойкостью к высоким температурам. Сплавы бериллия, будучи в 1,5 раза легче алюминия, тем не менее прочнее многих специальных сталей. Свою прочность они сохраняют до температуры 700 … 800 градусов Цельсия. Бериллий стоек к радиации.По своим физическим свойствам, как видно, бериллий сильно отличается от лития, но по топологии атомов они почти не различимы; отличие лишь в том, что атом бериллия как бы “сшит с запасом”: если атом лития напоминает тесный костюм школьника на взрослом человеке, то атом бериллия, наоборот, — просторный костюм взрослого на фигуре ребенка. Избыточная длинна шнура атома бериллия при одинаковой конфигурации его с литием образует более пологие очертания с радиусами изгибов, превышающими минимальные критические. Такой “запас” кривизны у атомов бериллия позволяет их деформировать вплоть до выхода на предел изгибов шнуров.
Топологическое сходство атомов лития и бериллия говорит о том, что четкой границы между ними нет; и невозможно сказать, какой наибольший размер имеет атом лития и какой наименьший — атом бериллия. Ориентируясь только на табличный атомный вес (а он усредняет все значения), можно считать, что шнур среднего по размерам атома бериллия состоит приблизительно из 16 500 связанных электронов. Верхний предел размеров атомов изотопов бериллия упирается в минимальный размер атома следующего элемента — бора, конфигурация которого резко отличается.
Запас по радиусам кривизны шнуров атомов бериллия сказывается в первую очередь на соединении их между собой в момент затвердевания металла: они примыкают друг к другу уже не короткими (точечными) участками как у лития, а длинными границами; контуры атомов как бы подстраиваются друг под друга, деформируясь и прилегая друг к другу максимально возможным образом; поэтому такие соединения очень прочны. Свою упрочняющую способность атомы бериллия проявляют и в соединениях с атомами других металлов, то есть в сплавах, в которых бериллий используется в качестве присадок к тяжелым металлам: заполняя пустоты и присасываясь своими гибкими желобами к атомам основного металла, атомы бериллия скрепляют их как клей, делая сплав очень прочным. Отсюда следует, что прочность металлов определяется длинами слипшихся участков присасывающих желобов атомов: чем длиннее эти участки, тем прочнее металл. Разрушение металлов происходит всегда по поверхности с самыми короткими слипшимися участками.
Запас по радиусам изгиба шнуров атомов бериллия позволяет им деформироваться без изменения соединений между собой; в результате деформируется все тело; это уже — упругая деформация. Упругая она потому, что в любом исходном состоянии атомы имеют наименее напряженные формы, а при деформации вынуждены терпеть некоторые “неудобства”; и стоит только деформирующей силе исчезнуть, как атомы возвратятся в свои исходные менее напряженные состояния. Следовательно, упругость металла определяется избытком длин шнуров его атомов, позволяющим их деформировать без изменения участков взаимного соединения
.
С упругостью бериллия связана его жаропрочность; она выражается в том, что тепловые движения атомов могут происходить в пределах упругих деформаций, не вызывающих изменение соединений атомов между собой; поэтому в общем жаропрочность металла определяется, как и упругость, избытком длин шнуров его атомов. Снижение прочности металла при высоком нагреве объясняется тем, что тепловые движения его атомов уменьшают участки соединений их между собой; а когда эти участки полностью исчезают, происходит плавление металла.
Упругости бериллия сопутствует его хрупкость. Хрупкость может рассматриваться в общем случае как антипод пластичности: если пластичность выражается в возможности атомов изменять свои взаиморасположения с сохранением соединяющих участков, то хрупкость выражается, в первую очередь, в том, что у атомов такой возможности нет. Всякое взаимное смещение атомов хрупкого материала может происходить только при полном разрыве их связей; у этих атомов нет иных вариантов соединений. У упругих материалов (у металлов) хрупкость характеризуется еще и тем, что она — как бы прыгающая: возникшая в результате чрезмерных напряжений трещина с быстротой молнии распространяется по всему сечению тела. Для сравнения: кирпич под ударами молотка может крошиться (это — тоже хрупкость), но не раскалываться. “Прыгающая” хрупкость бериллия объясняется тем, что его атомы соединены между собой не лучшим образом, и все они напряжены; и стоит только нарушиться одной какой-то связи, как граничные атомы стремительно начнут “выпрямляться” в ущерб соединений со своими соседями; связи последних также начнут разрушаться; и этот процесс примет цепной характер. Следовательно, хрупкость упругих металлов зависит от степени деформаций соединенных между собой атомов и от отсутствия возможности изменения связей между ними
.Радиационная стойкость бериллия объясняется все тем же запасом в размерах его атомов: шнур атома бериллия имеет возможность спружинить под жестким радиационным ударом, не доходя до своей критической кривизны, и тем самым сохраниться неразрушенным.
И тем же можно объяснить светло-серый цвет бериллия и отсутствие у него яркого металлического блеска, такого, например, как у лития: световые волны эфира, падая на нежесткие шнуры поверхностных атомов бериллия, поглощаются ими, и только часть из волн отражается и создает рассеянный свет.
Плотность бериллия почти в четыре раза больше чем у лития только потому, что плотность шнуров его атомов выше: они соединяются между собой не в точках, а длинными участками. В то же время в сплошной своей массе бериллий — достаточно рыхлое вещество: он всего лишь в два раза плотнее воды.
4.5. Бор
Паспортные данные бора: он занимает пятую позицию в таблице Менделеева и относится к третьей группе периодической системы, то есть он — уже не металл; атомная масса бора 10,811; у него известны два изотопа с атомными массами 10 и 11; плотность бора2,3 грамма в кубическом сантиметре; температура плавления 2075 градусов Цельсия; бор предстает обычно в мелкокристаллическом виде.
Очень чистый бор бесцветен, однако чистым он практически никогда не бывает и поэтому выглядит чаще всего как темно-серый, бурый или даже как черный. В физическом и, особенно, в химическом отношениях бор очень сильно похож на своего соседа — на углерод: он также соединяется с кислородом, с серой, с азотом, с фосфором, с металлами; соединяются они и между собой. Все эти соединения нуждаются в “поджоге”; при обычной же температуре бор соединяется только со фтором. С азотом и углеродом бор образует сверхтвердые нитриды и карбиды, а с водородом — гидриды, которые по аналогии с углеводородами называют еще бороводородами. Бор может участвовать также в соединениях полимеров.
В топологическом плане переход от конфигурации атома бериллия к конфигурации атома бора — ступенчатый, и поэтому, казалось бы, можно довольно точно указать, границу между их размерами; но на самом деле она не такая уж конкретная: в одном случае она может сместиться в сторону бериллия, в другом — в сторону бора, — поэтому нет смысла искать ее однозначной. Будем считать, что она пролегает где-то между 16 500 и 18 400 связанных электронов. Это — нижняя граница; верхней границы у атома бора нет: он плавно переходит в атом углерода.
Топологию атома бора можно рассматривать как продолжение формообразования атома бериллия, но лучше начать сначала. Итак, при столкновении двух фронтов эфира могло возникнуть микрозавихрение в виде вращающейся торовой оболочки (типа дымового кольца) диаметром приблизительно в 5 900 эфирных шариков. Это кольцо из круглого превращается в овал; при самом наибольшем сплющивании, когда радиусы закруглений на его концах уменьшатся до предельных значений, то есть до 285 шариков, его длина окажется в 30 раз больше этих радиусов. Длинные стороны овала будут продолжать сближаться до полного соприкосновения, а его концевые петли завернутся, будем считать, вверх и устремятся навстречу друг другу. Столкнувшись своими вершинами, петли завернутся еще раз в том же направлении и устремятся внутрь (вниз); погонит их туда присасывание концевых петель. Завершится этот этап тем, что вершины петель упрутся в середину спаренных шнуров; точно так же формируется атом бериллия.
А дальше произойдет следующее. Спаренные шнуры, замыкающие концевые петли, также начнут слипаться между собой и вызовут удлинение атома: из формы, напоминающей яблоко, атом превратится в подобие перца. Указанное слипание спаренных шнуров теоретически должно было бы прекратиться в момент, когда вершины петель упрутся в середину шнуров, но — и в этом весь секрет — слипшиеся петли могут промахнуться и проскочить мимо или, упершись в шнуры, по случайности могут соскочить с них; и тогда слипание спаренных шнуров продолжится. Вывернувшиеся изнутри атома спаренные петли начнут разворачиваться и уходить вверх, а внизу, как следствие, возникнут уже спаренные новые, вторичные петли. Если бы длина торового шнура была достаточной (такой она будет только у атома углерода), то атом бора вытянулся бы в линию, на концах которой располагались бы перпендикулярно ориентированные между собой спаренные петли. Но атом бора еще относительно мал, и его вывернувшиеся в сторону и уходящие вверх спаренные петли замрут в каком-то полуподнятом положении, напоминающем открытый семафор, или шлагбаум, или вождя с поднятой рукой. Произойдет это потому, что вызывающему подъем петель сближению спаренных шнуров окажут сопротивление вторичные петли, исходно спаренные и не желающие размыкаться. (Все эти манипуляции становятся очевидными, если производить их на резиновом кольце.) Так образуется и так выглядит атом бора. Обратим внимание на то, что четыре шнура, соединяющие его разнесенные петли, будут выкрученными.
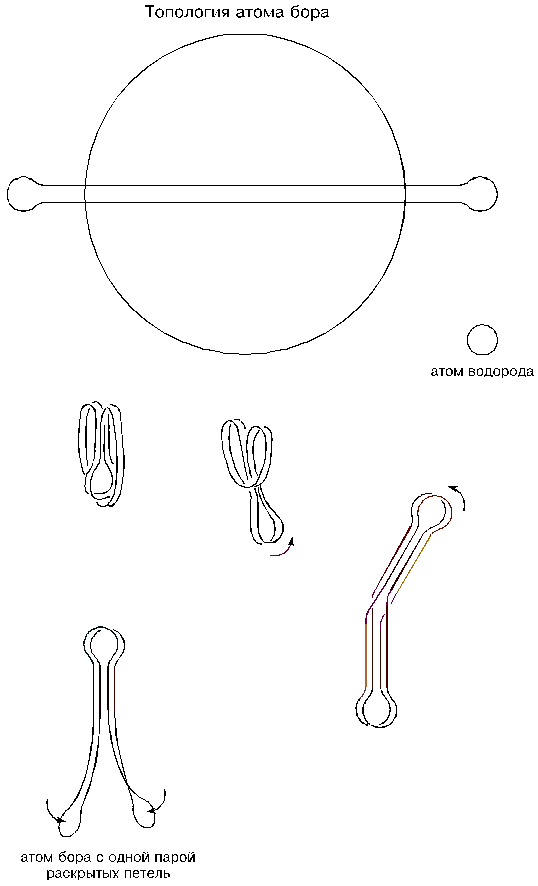
Охарактеризуем полученный атом бора с точки зрения его присоединительных способностей: у него — четыре петли и два присасывающих желоба; петли — попарно сомкнувшиеся, а желоба — неконтурные и с разворотом (выкрученные).
Между собой атомы бора могут соединяться только с помощью петель. Достаточно иметь повышенную температуру и (или) повышенное давление, чтобы петли атомов раскрылись и начали перекрестно соединяться между собой. Раскрытию петель способствуют выкрученные шнуры; они после такого раскрытия становятся прямыми, но одна из пар петель вынуждена при этом развернуться так, что ее присасывающие воронки оказываются снаружи, а сами петли расходятся веером.
С атомами металлов атомы бора могут соединяться только с помощью присасывающих желобов; при этом его желоба вынуждены выпрямляться (избавляться от выкрученности) и раскрывать с одной стороны петли, а открытые петли, то есть петли с открытыми присасывающими воронками, ведут себя агрессивно: они готовы присосаться к первой попавшейся петле и при том даже высвобождают тепло. Соединение атомов бора с помощью желобов может осуществляться не только с атомами металлов, но и с атомами других химических элементов, у которых есть присасывающие желоба; а такие соединения могут иногда вызывать распрямление атомов бора в первоначальный длинный овал с двумя петлями на концах; такой вытянувшийся атом бора может опутывать другие атомы самым замысловатым образом.
Соединение петлями — наиболее прочное, поэтому пространственные модификации из атома бора тоже очень прочные; этому способствует еще и то, что атомы бора образуют очень простые, прямоугольные конструкции (кубические кристаллы), в которых могут отсутствовать случайные искажения — так называемые дислокации. Тепловые движения атомов поглощаются их прямыми участками и почти не затрагивают петель; отсюда — довольно высокая температура плавления. Плотность бора, определяемая расположением шнуров в межатомных соединениях, не очень высокая, но все же выше чем у бериллия, в 1,24 раза.
Идеально построенные кубические кристаллы бора имеют такую простую решетку, сквозь которую может свободно проникать свет; такие кристаллы прозрачны. Сквозь искаженные кристаллы или кристаллы с вкраплениями атомов других химических элементов свет свободно проникать не может и поглощается атомами; отдают они его уже на более низких частотах красного спектра или даже в невидимом инфракрасном диапазоне, — все зависит от собственных частот прямых участков между концевыми петлями; такие кристаллы либо бурые, либо даже черные.
4.6. Углерод
Углерод занимает шестую позицию в таблице Менделеева; его атомная масса равна 12,011. При обычных условиях он химически инертен, при высоких температурах соединяется со многими элементами. Температура плавления углерода равна 4020 градусов Кельвина. В природе известны в основном две кристаллические формы углерода — алмаз и графит.
Алмаз — полиморфная модификация углерода; в виде кубической сингонии алмаз бесцветен, но его октаэдрические кристаллы приобретают окраску. Плотность алмаза равна 3, 5 грамма в кубическом сантиметре. Он — самый твердый природный материал, обладает высоким показателем оптического преломления и в виде крупных кристаллов относится к числу драгоценных камней. Алмаз — полупроводник.
Графит — наиболее распространенная и устойчивая гексогональная полиморфная модификация углерода, имеющая чешуйчатые агрегаты. Цвет графита — от темно-серого до черного. Его плотность равна 2,2 грамма в кубическом сантиметре. Графит огнеупорен (изделия из него выдерживают температуру в 3700 градусов Цельсия) и вообще химически стоек; он обладает электропроводностью. В технике он используется в качестве твердой смазки.
Известны также линейные полимеры углерода — карбин и поликумулен; они представляют собой высокопрочные нити, которыми армируют композиционные материалы. Карбин обладает полупроводниковыми свойствами: под действием света его проводимость сильно увеличивается.
Углерод может соединяться с металлами, образуя карбиды. Карбиды вольфрама, титана, тантала и ниобия очень тугоплавки, тверды, износостойки, жаропрочны; из них изготовляют пластины режущих инструментов; детали из карбидов используют в турбинах и реактивных двигателях.
Но больше всего известны органические соединения углерода: они являются основной составной частью растительного и животного мира. Все горючие ископаемые — нефть, газ, торф, сланцы — построены на углеродной основе; особенно богат углеродом каменный уголь. Кроме природных существует множество искусственных полимеров на основе углерода. Общее число известных науке органических соединений превышает 7 миллионов.
Топология атома углерода
Вместе с бором углерод занимает на размерной шкале атомов диапазон приблизительно от 18 000 до 25 000 связанных электронов; “официальный” размер атома углерода, соответствующий его атомной массе, составляет 22 100 электронов. Атомы изотопов углерода могут отличаться размерами друг от друга довольно значительно; их разброс может составлять 4 500 электронов или приблизительно 20 процентов от номинала. В среднем атом углерода больше атома бора на 3 400 электронов; это, как раз, — то увеличение, которое делает углерод отличающимся от бора; а это отличие, главным образом, состоит в том, что у углерода не бывает тех “агрессивных” проявлений, какие есть у бора.
Топология атома углерода почти не отличается от топологии атома бора. Точно так же первоначальный тор деформируется в овал; потом на концах овала образуются петли; эти петли загибаются, стыкуются своими вершинами, еще раз загибаются, уходят, слипаясь, внутрь, отклоняются в сторону, выворачиваются и вытягиваются, образую в результате четырехшнурный жгут со спаренными петлями на концах.
Топология атома углерода по линии литий-бериллий-бор-углерод — основная, но возможен и такой вариант, когда литиево-бериллиевый загиб петель внутрь не происходит. В нем отпадает необходимость, если концевые петли овала случайным образом загнутся так, что их присасывающие стороны
окажутся обращенными друг к другу, то есть во внутрь. Устремившись навстречу и столкнувшись вершинами, петли начнут взаимно присасываться и вытягиваться в линию, образуя на другом конце шнуров вторичные петли. Таким образом атом углерода сразу же приобретает свою окончательную вытянутую формы. Вторичные петли в таком случае оказываются взаимно отталкивающими: их присасывающие стороны будут располагаться снаружи. Отталкиваясь, они разойдутся веером и поспешат присосаться к таким же петлям других атомов. В крайнем случае, если этим петлям не представится возможность найти себе пары на стороне, они, выкручиваясь, замкнутся сами на себя. Такова топология окончательно сформировавшегося одиночного атома углерода. У него, как и у атома бора, — четыре петли и два желоба; петли — попарно сомкнувшиеся, а желоба — выкрученные.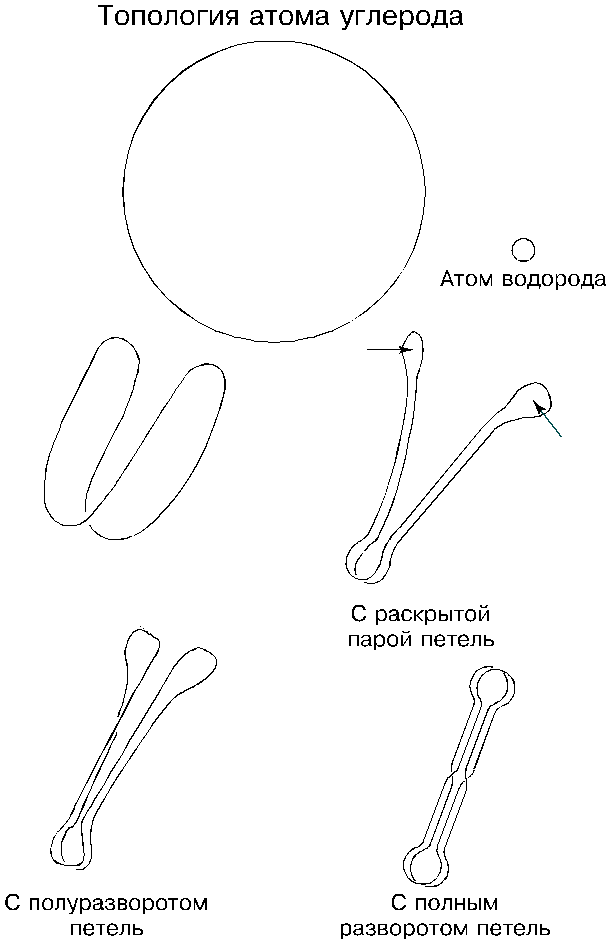
Стереометрия аллотропии углерода.
Атомы углерода могут объединяться между собой в разных комбинациях, и каждый вид объединений дает свою оригинальную аллотропическую модификацию. Соединения осуществляются в основном петлями, но могут быть и соединения атомов с помощью желобов.
Для того, чтобы атомы углерода начали соединяться между собой петлями, последние необходимо предварительно раскрыть. Осуществить это можно различными способами: тепловым воздействием, давлением, жесткими волнами эфира, с помощью катализаторов или комбинацией этих факторов. Наиболее распространенную аллотропическую модификацию углерода — графит можно получить, например, путем нагревания антрацита без доступа воздуха. Рассмотрим этот процесс более подробно.
Одиночный атом углерода, как мы отмечали, представляет собой дважды сложенное кольцо: сначала исходный тор сплющивается в овал, то есть растягивается, а потом складывается еще раз; полученная конфигурация напоминает фигуру шва теннисного мяча. Если вдвое сложенный замкнутый шнур атома углерода растянуть, то на концах образуются парные петли. (Напомним, что радиусы этих петель равны 285 шарикам.) Полученная форма одиночного атома — не окончательная: одна из пар петель окажется сложенной отталкивающими сторонами — такого быть не может, и эти петли постараются как-нибудь вывернуться, чтобы вновь соединиться, но уже обратными присасывающими сторонами. Длина сложенного атома углерода позволяет это сделать, и петли развернутся и сложатся, но при этом спаренные шнуры, то есть желоба, будут выкручены. Очевидно, такая форма одиночного атома углерода не очень устойчива, так как в ней присутствует противоборство желобов и петель: выкрученные желоба хотели бы выпрямиться в ущерб слипшимся петлям, а те, в свою очередь, будут всеми своими силами сохранять свое слипание.
Частичное разрешение противостояния желобов и петель может произойти даже при самом незначительном нагреве или даже без него — в нормальных условиях: если два атома случайно столкнутся между собой вывернутыми петлями, то эти петли могут раскрыться (как ладони) и состыковаться, образовав таким образом молекулу. Можно даже предположить, что в антраците углерод находится именно в таком молекулярном состоянии.
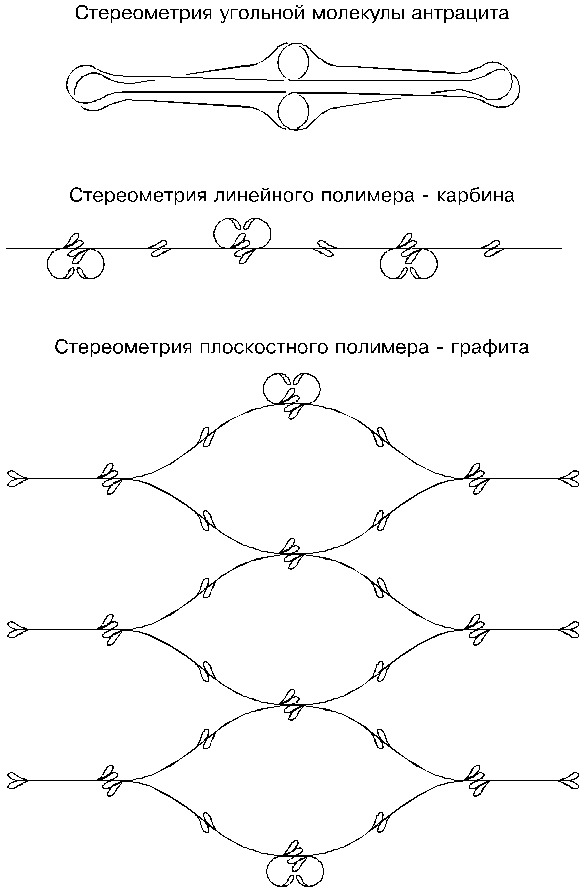
При более высоком нагреве молекулы углерода из двойных атомов соединяются в графит. При случайном столкновении двух молекул своими концами их петли могут раскрыться и соединиться перекрестно, то есть к присасывающей стороне петли одной молекулы может прилипнуть присасывающей стороной петля другой молекулы. Такое соединение первых двух молекул между собой можно считать началом роста кристалла графита. В перекрестном соединении двух молекул слипшимися оказываются только их две петли, а две другие оказываются раскрытыми. Они будут искать себе пары, и при случайном столкновении с другими молекулами раскроют их концевые петли и выберут себе по одной из них, образовав таким образом следующие межмолекулярные связи. Подобные подсоединения будут происходить и в продольном и в поперечном направлениях до тех пор, пока будут находиться очередные свободные молекулы углерода и пока их тепловые движения позволят это делать. Возникающий кристалл графита будет плоским, так как петли всех соединившихся молекул имеют параллельную ориентацию.
После прекращения роста кристалла процесс его формирования продолжится: должна решится судьба оставшихся открытыми петель, располагающихся по бокам кристалла (на концах кристалла они замкнуты). Раскрытые боковые петли соседних атомов, тех, что образовали в самом начале молекулы, устремятся навстречу друг другу, столкнутся своими вершинами и, слипаясь, загнутся вовнутрь, напоминая тем самым образование атомов лития и бериллия.
Возникшие кристаллы графита будут иметь, как принято говорить, формы чешуек, то есть будут плоскими. Если же уточнять, то их формы больше будут напоминать вытянутые пластины с анизотропными свойствами, чем гексогональные изотропные чешуйки. Кристалл графита имеет возможность в любое время продолжить свой рост; но для того, чтобы расти ему в ширину, нужно разорвать только что слипшиеся “в сердечко” петли соседних атомов, а это сделать уже не легко.
Пластины графита могут собираться в стопки, присасываясь одна к другой желобами, и даже не ими, а отдельными их точками — выступающими боковушками петель. Эти соединения непрочны, и поэтому карандаш можно чинить простым ножом. В то же время разорвать отдельный кристалл графита практически невозможно: настолько крепки его петлевые соединения. Они противостоят даже химическому воздействию; поэтому графит — достаточно инертное вещество. Его химическая стойкость, механическая прочность и тонко пластинчатая структура делают его хорошей смазкой трущихся поверхностей при большом удельном давлении.
Черный цвет графита объясняется тем, что прямые участки шнуров его атомов настолько длинные, что могут “звучать” только на низких инфракрасных частотах. Понятна также радиационная стойкость графита: его атомы не имеют опасных изгибов, готовых привести к излому упругих шнуров при жестких ударах радиации. И еще — об электропроводности графита: у его атомов все присасывающие желоба почти полностью открыты, не имеют пересечений и удобно соединяются между собой петлями, — и все это способствует тому, что электроны могут свободно перемещаться по кристаллам графита. Некоторое сопротивление они испытывают только на стыках петель. Но на боковых сторонах кристаллов, где присасывающие желоба образуют “сердечки” как у атомов металлов, сопротивление движению электронов почти полностью отсутствует. В толстом слое графита электроны имеют возможность, перескакивая с одной цепочки атомов на другую, избегать петлевых стыков и поэтому испытывают меньшее сопротивление своему движению.
Не избежать электронам петлевых стыков только в том случае, если кристаллы графита будут представлять собой отдельные нити. Выше мы отмечали, что кристалл графита анизотропен: его структуры в продольном направлении и в поперечном — различные, и обусловлено это тем, что продольное наращивание кристалла требует одних физических условий, а поперечное — других. При наличии и тех и других кристалл растет и в длину и в ширину; но если в действительности окажутся только первые условия и не будут соблюдены вторые, то кристаллы начнут вытягиваться в нити; появится новая аллотропическая модификация углерода — карбин. О нем можно сказать так: идеальный кристалл карбина представляет собой тот же кристалл графита, но с шириной в один атом.
Карбин относится к линейным полимерам углерода. Его отличительной особенностью является то, что сплетенный из его непрерывных нитей в сотни раз прочнее остальных, и поэтому нити карбина используют для армирования сверхпрочных композиционных материалов. Другой особенностью этих нитей является то, что их электропроводность значительно ниже, чем у графита (с этого мы начали разговор о нем). Правда, обнаружено, что под воздействием света электрическое (электронное) сопротивление карбина резко снижается; и в этом проявляются его полупроводниковые свойства: короткие, но жесткие волны света подталкивают электроны и помогают им преодолевать неудобные переходы в петлевых соединениях.
Но самой, пожалуй, интересной (точнее — привлекательной) аллотропической модификацией углерода является пространственный полимер — алмаз. Кристалл алмаза выращивается при сочетании определенных условий, основными из которых являются давление в 60 000 атмосфер и температура в интервале 1 600 … 2 000 градусов Цельсия. Главным из этих факторов является давление, а температура в основном определяет скорость роста.
В формировании кристалла алмаза принимают участие одиночные атомы углерода (в графите они — парные) с нормальной взаимоперпендикулярной ориентацией петель на противоположных концах, при этом у одной пары петель атома присасывающие стороны располагаются снаружи, а у другой — изнутри., так что шнуры стволов атомов — не выкрученные, а нормальные. Петли атома расходятся от ствола веером с максимальным углом между ними в 90 градусов. Конечно, в свободном состоянии атомы углерода такими быть не могут. Поэтому можно предположить, что кристаллы алмаза выращиваются не из чистого углерода, а из связанного, например из углеводорода, в частности из метана: в нем атом углерода имеет самые подходящие формы для подсоединения к кристаллу.
Кристалл алмаза представляет собой трехмерную ортогональную конструкцию без косых, диагональных связей. Особенностью кристалла является то, что узлы соединений атомов в нем — не пространственные, а плоские; трехмерность общей конструкции возникает вследствие того, что плоские двумерные узлы на концах каждого из атомов ориентированы перпендикулярно друг другу.

Рассмотрим устройство межатомного узла, имея в виду, что все узлы кристалла — абсолютно одинаковые. Он объединяет четыре атома; все они сходятся к нему по двум взаимно перпендикулярным прямым линиям. Петли одной пары атомов, лежащих на общей прямой, имеют внешние присасывающие стороны, а петли другой пары, располагающейся на перпендикулярной прямой, — внутренние. В узле петли вторых атомов охватывают петли первых, и они накрепко слипаются; прочность их соединения определяет прочность алмаза. Других соединений, например с помощью желобов, кристалл не имеет.
Завершенные узлы, объединяющие по четыре атома, располагаются внутри кристалла, а на его поверхности они — некомплектные; их доукомплектование и есть рост кристалла. Представим себе незавершенный узел, объединяющий только три атома углерода; у него слипшимися будут только две пары петель, а оставшиеся две петли от встречно расположенных атомов будут прикрыты атомами водорода. Также прикрытыми будут петли того атома углерода, который должен присоединиться к данному узлу. Учитывая то, что метан в сложившихся условиях рождения кристалла находится в предплазменном состоянии, когда атомы водорода еле-еле удерживаются на своих местах, присоединяемый атом углерода под воздействием давления отжимает атомы водорода и замыкает своими петлями освободившиеся петли узла; узел становится завершенным.
Не будет особых проблем и при доукомплектовке узла из двух атомов при дополнении его третьим, уже встроенным в кристалл и готовым к присоединению; этому третьему атому не остается ничего другого, как искать своим свободным концом возможности присоединения к некомплектному узлу, и он ее находит.
Труднее всего происходит зарождение нового узла; здесь возможны два варианта, один из которых кристаллу неприемлем; встает вопрос: как он избегает его? Неприемлемым является соединение петель однонаправленными сторонами, например наружной с наружной или внутренней с внутренней. Значит, если на свободном конце атома углерода — петли с внутренними присасывающими сторонами, то первое подсоединение к нему должно быть петель другого атома с внешними сторонами. Остается предположить, что в случае зарождения нового узла с неправильным подсоединением очередного атома (а таких случаев — половина от общего числа) не может возникнуть комбинация с встраиванием ее в кристалл, и она рано или поздно будет разрушена. И только при правильном зарождении узла атомы углерода, его образующие, встраиваются в кристалл, и там они чувствуют себя в безопасности.
Рост кристалла прекращается тогда, когда физические условия изменяются настолько, что не отвечают требованиям роста. Какие это условия? Мы их уже упоминали: во-первых, они должны создавать предплазменное состояние исходного материала; во-вторых, они должны разрушать неправильные комбинации атомов и, в-третьих, они должны быть бессильны разрушить правильно соединенные атомы. Получается так, что физические параметры условий роста кристалла алмаза должны укладываться в определенный интервал: не ниже и не выше. Если не будут выполняться эти требования, то и большого кристалла не будет. Особенно обращаем внимание на второе условие — на разрушение неправильных комбинаций; реализовать его в условиях производства искусственных алмазов можно простым механическим перетиранием кристаллов, дробящим неправильные из них, и не приносящим вреда полноценным.
После завершения роста кристалла алмаза все его поверхностные узлы будут недоукомплектованы; это означает, что он будет окружен “щетиной” из незамкнутых между собой петель атомов углерода. В естественных условиях петли притягивают к себе любой окружающий мусор и делают алмаз невзрачным. При огранке мусор удаляется и замещается прозрачным веществом. Если очищенный кристалл ничем не покрыть, то он скоро снова обрастает мусором.
Предложенная модель кристалла хорошо согласуется с физическими характеристиками алмаза. Его твердость выражается в том, что он не способен пластически деформироваться и противостоит механическому разрушению. Объясняется это тем, что атомы углерода в кристалле не имеют возможности изменять свое положение (они соединены петлями, а не желобами), связаны между собой перекрестными пространственными связями и связи эти образуются полноценными петлевыми соединениями. К этому следует еще добавить то, что кристалл алмаза не имеет дислокаций и инородных включений, за исключением, может быть, атомов бора. Последние, если их размеры близки к размерам атомов углерода, не только не ослабляют кристалл, но, напротив, упрочняют его. Разные длины атомов (у углерода, как мы знаем, они — тоже разные) делают всю конструкцию кристалла очень жесткой, противостоящей, в частности, косому сдвигу; поэтому алмаз не имеет даже упругих деформаций.
Прозрачность алмаза выражается в том, что его кристаллы имеют сквозные прямолинейные щели, сквозь которые волны эфира (света) проникают без препятствий; к тому же, на самой поверхности кристалла плотность атомов (их шнуров) не очень большая, и поэтому они не отражают свет. В то же время правильная внутренняя структура алмаза позволяет ему собирать свет и направлять его концентрированными пучками в определенных направлениях.
Стволы атомов углерода, то есть их прямые участки, в кристалле алмаза — очень короткие, так как большая часть их длины уходит на отогнутые концевые петли, поэтому если и “звучат” эти прямые участки, то только на высоких (голубых и далее) частотах.
С точки зрения электропроводности алмаз, как известно, — полупроводник: в пределах одного атома электроны движутся вдоль его присасывающих желобов, но при переходе на соседний атом они должны сначала перескочить на желоб, образованный слипшимися петлями, а затем уже с них — на присасывающий желоб другого атома; указанные перескакивания и определяют электрическое сопротивление. Перескакивания могут быть облегчены воздействием внешних факторов: жесткого света, повышенной температуры и прочих, — и это определяет полупроводниковые свойства алмаза.
Стереометрия углеводородов.
Молекулы углеводородов построены только у атомов углерода и водорода; вариантов их соединения — огромное количество. Их можно классифицировать по разным признакам: по степени насыщенности водородом (насыщенные и ненасыщенные), по разомкнутости-замкнутости (ацикличности и алицикличности), по фазовому состоянию (газообразные, жидкие, твердые), изомерности и по другим.
Самым мелкомолекулярным насыщенным углеводородом является метан: его молекула состоит из одного атома углерода и четырех атомов водорода. Не трудно себе представить стереометрию этой молекулы: на каждой петле атома углерода на их присасывающих сторонах закреплены по атому водорода; на одном конце атома углерода водородные торы роспологаются снаружи, а на другом — изнутри; петли с прилипшими к ним атомами водорода расходятся от ствола атома углерода веером, причем угол расхождения петель с внутренними присасывающими сторонами больше, чем с внешними.
Если атом метана дополнять группой из одного атома углерода и двух атомов водорода, то получится гомологический ряд атомов насыщенных углеводородов: этан (два углерода и шесть водородов), пропан (три углерода и восемь водородов), бутан (четыре углерода и десять водородов), пентан (пять углеродов и двенадцать водородов) и так далее.
Стереометрия молекул этих углеводородов — уже сложнее, чем у молекулы метана, и, кроме того, они видоизменяются у каждого углеводорода в отдельности; такие видоизменения называются изомерами; определяются они соединениями петель атомов углерода. У этана возможны три варианта: его два атома углерода могут слипаться внешними сторонами, внутренними или перекрестно. У пропана, имеющего три атома углерода, таких комбинаций может быть четыре; у бутана — больше, а у пентана — еще больше. Но во всех этих изомерных стереометриях обнаруживается следующая закономерность: если петли соединяются одними сторонами (либо внешними, либо внутренними), то стволы атомов углерода в молекулах располагаются в линию, параллельно друг другу; а если петли соединяются перекрестно (внешней стороной с внутренней), то стволы атомов углерода располагаются перпендикулярно или близко к тому. Говоря о стереометрии углеводородов, мы не должны забывать, что петли на одном конце атома развернуты по отношению к петлям на другом его конце под прямым углом; из-за этого любая молекула представляет собой пространственную конструкцию (но на плоском листе бумаги такие объемные конструкции приходится изображать плоскими).

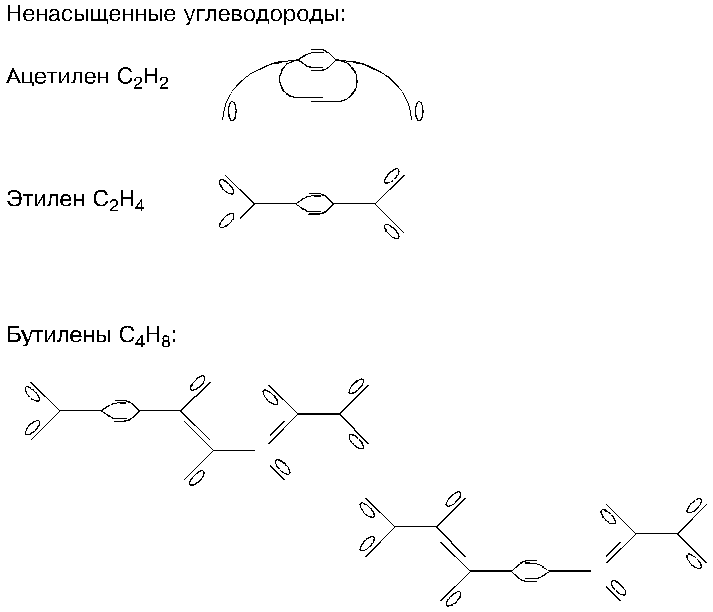
Стереометрия позволяет ответить на вопрос: почему некоторые углеводороды газообразны, другие в нормальных условиях являются жидкостями, а третьи — твердыми? Отметим, что газообразны мелкомолекулярные углеводороды: метан, этан, пропан, бутан; жидкостями являются углеводороды с более крупными молекулами, начиная с пентана, молекулы которого содержат по пять атомов углерода, — и кончая углеводородом с шестнадцатью атомами углерода в молекуле; и наконец, твердыми являются парафины, молекулы которых содержат более девятнадцати атомов углерода; наиболее твердые парафины — их называют церезинами —имеют молекулы, содержащие более тридцати семи атомов углерода, и мелкокристаллическую структуру.
Ответ на поставленный вопрос будем искать все в той же пушистости. Атомы углерода сами по себе не имеют противоборствующих участков и поэтому не пульсируют. Пульсируют и очень интенсивно атомы водорода — мы об этом знаем. Так вот, в соединениях тех и других, то есть в углеводородах, углерод не подавляет колебания водородных атомов, и те создают вокруг него стоячие тепловые поля; плотность их вокруг молекулы может быть такой, что она вся превратится в пушистую частицу; а это уже — главный признак газообразности. Получается так, что атомы водорода своим порханием и своим стремлением поднять атом углерода в воздух напоминают сказочных пташек, уносящих с собой в высь прицепившуюся лягушку. Если у этих пташек — у водородных атомов — хватает сил, они делают молекулу газообразной; если не хватает, то — жидкостной; а уж если совсем не будет сил, то молекула останется прилипшей к твердому телу.
Кроме того пушистость углеводородной молекуле придают петлевые соединения атомов углерода; каждое такое соединение можно приравнять в этом смысле к одному атому водорода. Сказываются также расположение атомов водорода в молекулах углеводородов, конфигурация молекул, разумеется — температура и другие факторы.
Если учитывать только отношение количества атомов водорода плюс количество петлевых соединений к количеству атомов углерода в молекулах (назовем такое отношение коэффициентом пушистости), то у газообразных насыщенных углеводородов оно изменяется в пределах от 4 у метана (температура кипения минус 164,5 градуса Цельсия) до 3,25 у бутана (температура кипения минус 0,5 градуса); у жидкостных этот коэффициент колеблется от 3,2 у пентана (кипение при 36,1 градуса) до 3,063 у углеводорода с шестнадцатью атомами углерода; у парафинов — 3,053 до 3,029, а у церезинов — от 3,027 до 3,019.
Можно отметить еще такую закономерность: атомы водорода, располагающиеся на наружных сторонах петель углерода, создают большую пушистость, чем те, что располагаются на внутренних. Так у бутана, имеющего четыре наружных водорода, температура кипения равна минус 0,5 градуса, а у изобутана с пятью наружными водородами температура кипения еще ниже и составляет минус 11,7 градуса. То же самое наблюдается у жидкостей: пентан с шестью наружными водородами закипает при 36,1 градуса Цельсия, а изопентан с семью наружными водородами при 27,9 градуса.
Стереометрия ненасыщенных углеводородов — несколько сложнее. Возьмем для примера ацетилен, молекула которого состоит из двух атомов углерода и двух атомов водорода. Он получается при реагировании карбида кальция с водой или из метана при пропускании через него электрических разрядов. Отличительной особенностью стереометрии ацетилена является тройная связь атомов углерода в его молекулах. Это означает, что, во-первых, петли с внутренними присасывающими сторонами одного атома углерода охватывают петли с наружными присасывающими сторонами второго атома, и во-вторых, из оставшихся петель две, по одной от каждого атома, загнуты навстречу друг другу и образуют накладку типа той, что есть у атома гелия; и только оставшиеся незамкнутыми остальные две петли соединены с атомами водорода.
Позволим себе предположить, как возникает молекула ацетилена в момент проскакивания электрического разряда в метане. Разряд превращает метан в плазму; по-просту говоря, он срывает с атомов углерода атомы водорода. Освободившиеся атомы углерода соединяются между собой по-парно максимально возможным образом, то есть тремя петлями, как было сказано выше. Те петли, что образуют гелиевую накладку, стягиваясь, изогнут вновь образованную молекулу так, что две оставшиеся незамкнутыми петли не смогут дотянуться друг до друга и вынуждены будут поймать и присосать к себе находящиеся поблизости атомы водорода.
Характерной чертой стереометрии ненасыщенных углеводородов является двойная связь атомов углерода, когда петли с внутренними присасывающими сторонами одного атома охватывают петли с наружными сторонами другого атома; назовем такое соединение скобою. Она наблюдается и у ацетилена, и у этилена, и у бутилена, и у всех других ненасыщенных углеводородов; благодаря ей количеств атомов водорода в молекулах таких углеводородов уменьшается.
Скоба сильно пульсирует; ее пушистость можно оценить приблизительно в 3,1 тепловых поля атомов водорода. С учетом этого коэффициент пушистости этилена оказывается равным 3,55, и он по газообразности располагается между метаном (4) и этаном (3,5); температура вскипания этилена (минус 103,8 градуса Цельсия) выше чем у метана (минус 164,5 градуса), но ниже чем у этана (минус 88,6 градуса). Коэффициент пушистости бутилена с учетом действия скобы составляет 3,275, и бутилен со своей температурой кипения минус 6,3 градуса располагается между пропаном (коэффициент пушистости 3,33, температура кипения минус 42,1 градуса) и бутаном (коэффициент 3,25, температура минус 0,5).
Особая пушистость — у ацетилена; эта особенность вызвана его оригинальной стереометрией. Если оценить пушистость гелиевой накладки в 1,7 водородных тепловых поля, то коэффициент пушистости ацетилена составит 3,4, и он со своей температурой кипения минус 75 градусов займет место между этаном и пропаном.
Завершая разговор об углеводородах, отметим их бесцветность; она объясняется все тем же: атомы в молекулах углеводородов не имеют таких длин прямолинейных участков шнуров, которые колебались бы (“звучали”) на видимых человеческим глазом частотах.
Стереометрия и топология карбидов.
Карбиды, то есть соединения углерода с металлами (и некоторыми неметаллами, например с кальцием), имеют свою особую стереометрию; она характерна тем, что атомы в них соединяются не петлями, как в углеводородах, а желобами; при этом конфигурация атомов сильно видоизменяется, то есть стереометрия карбидов сопрягается с топологией атомов в них. Некоторое изменение форм атомов углерода наблюдалось, как мы видели, и в аллотропических модификациях, и в молекулах углеводородов; но там это выражалось в основном в развороте или отгибе концевых петель; но стволы атомов, состоящие из спаренных желобов, сохранялись почти неизменными. В карбидах атомы углерода могут трансформироваться до неузнаваемости.
Карбиды, как известно, получают прокаливанием при высоких температурах смеси порошков металлов или их оксидов с углем в электрических печах. Комбинацией электронного и теплового воздействия смеси приводятся в состояние плазмы, когда атомы металла разъединяются и легко скользят, с молекул оксидов срывается кислород, а стволы атомов углерода напоминают пучок бренчащих струн, утративших свое единство. В таком состоянии атомы металлов и углерода, перемешиваясь, находят такие формы контакта, которые противостоят электронно-тепловому разрушению.
Поясним сказанное на примере. Пусть прокаливается в электропечи смесь порошков бериллия и углерода; температура смеси поддерживается на уровне 1700 градусов. Бериллий в этих условиях становится жидким (его температура плавления равна 1284 градусам), а атомы углерода находятся в “пьяном” состоянии. Перемешиваясь, атомы бериллия и углерода будут находить такие соединения между собой, которые способны противостоять тепловым движениям: для их разрушения уже требуется температура в 2150 градусов; эти соединения называют карбидом бериллия. Процесс “подстраивания” будет происходить до тех пор, пока вся жидкая фаза не превратится в твердый карбид.
Пример с бериллием хорош тем, что сам бериллий дает нам подсказку в объяснении загадки карбидов. Когда мы рассматривали топологию атомов этого металла, то подчеркивали его способность склеивать атомы других металлов, делая их более прочными. Теперь точно таким же способом упрочняется сам бериллий, но в качестве клея уже используется углерод. В данном случае атом углерода напоминает своей формой атом бериллия: у него остаются замкнутыми между собой только первичные петли, а все тело выглядит как длинный желоб из спаренных шнуров, прилипший к соседним атомам бериллия и повторяющий их контуры. В образном сравнении атом углерода в карбиде напоминает тот же костюм взрослого, но не на фигуре школьника, а на груди ребенка.
Склеивание атомов металлов с помощью атомов углерода существенно повышает прочность их соединения, и это отражается на их жаростойкости, Чистый титан, плавящийся при температуре 1668 градусов, в соединении с углеродом остается твердым вплоть до температуры в 3140 градусов. Наряду с исключительной жаростойкостью и тугоплавкостью (порядка 3000 градусов) карбиды характеризуются высокой коррозионной стойкостью.
Некоторое исключение составляют карбиды марганца и железа: они термически и химически менее устойчивы, — и объяснить это можно тем, что они не являются полноценными металлами, то есть их атомы имеют несколько иные формы. К тому же, в железе углерод склонен объединяться в графит; смесь железа, карбида и графита известна как чугун.
Соединения атомов металлов с атомами углерода нельзя считать молекулами: эти соединения представляют собой сплавы; поэтому не совсем правильно изображать карбиды в виде формул молекул. То, что длины спаренных шнуров одного атома углерода хватает для того, чтобы опоясать два атома бериллия, не говорит о действительном соединении их между собой: соединиться они могут в любом количественном соотношении. Не поворачивается язык называть карбидные частицы кристаллами: они не имеют стереометрически правильную, регулярно повторяющуюся структуру, такую, например, как у графита или у алмаза.
Представление карбидов в виде сплавов, в которых атомы углерода похожи на атомы металлов, подтверждаются их металлическими признаками: большинство из них имеет высокую электропроводность, металлический блеск, положительный термический коэффициент электросопротивления и другие.
4.7. Азот
Азот располагается в таблице Менделеева под седьмым номером; его атомная масса равна 14,0067. Он представляет собой бесцветный газ и входит основной составляющей частью (78 процентов) в атмосферу Земли; обнаружен он также в газовых туманностях Вселенной и в солнечной атмосфере; есть он на Уране, Нептуне и на других планетах.
В природных условиях азот представлен в молекулярном виде; его молекула состоит из двух атомов; она — очень прочная и распадается лишь при нагреве выше 3000 градусов Цельсия. Азот сжижается при температуре ниже минус 196 градусов, а затвердевает ниже минус 210 градусов. В твердом состоянии он образует кубические и гексагональные модификации.
Азот химически малоактивен: в нормальных условиях он взаимодействует лишь с литием, образуя кристаллы. В то же время известны самые различные соединения азота. С водородом он образует аммиак, молекула которого состоит из одного атома азота и трех атомов водорода. Аммиак — тоже газ и тоже бесцветный; он сжижается при температуре ниже минус 34 градусов, а затвердевает ниже минус 78 градусов; получают его синтезом из простых веществ при температуре 400 … 500 градусов, под давлением 5 … 1000 атмосфер и в присутствии катализатора (обычно железа). Аммиак выделяется также при коксовании каменного угля. Современная химия представляет молекулу аммиака в виде трехгранной пирамиды с атомами в ее вершинах; атомы водорода в ней разнесены под углом 107 градусов.
Известны еще несколько соединений азота с водородом, и наиболее распространенное из них — гидразин (или диамид) — бесцветная жидкость, затвердевающая при температуре ниже двух градусов и закипающая при 113,5 градусах Цельсия. Молекула гидразина содержит два атома азота и четыре атома водорода. Гидразин менее устойчив, чем аммиак, и на воздухе горит с большим выделением тепла.
Из других соединений азота упомянем азотную кислоту, молекула которой состоит из одного атома азота, одного атома водорода и трех атомов кислорода; это — бесцветная жидкость, кипящая при 84,1 градусе, а при минус 41,6 градуса затвердевающая в прозрачную кристаллическую массу. Водный раствор азотной кислоты разрушает животные и растительные ткани, соединяется почти со всеми металлами и неметаллами.
Отметим еще так называемые нитриды — соединения азота с металлами и неметаллами. Одно такое соединение с литием мы уже упоминали: оно легко образуется, но также легко распадается при температуре выше 300 градусов. Другие нитриды металлов возникают труднее, но и отличаются высокой температурой плавления, что говорит о их термической и химической стойкости. Они характеризуются металлическим блеском, электронной проводимостью, а также высокой твердостью. Нитриды могут включать не один металл, а сплавы. Атомарные соотношения нитридов могут быть некратными, то есть на один атом металла может приходиться менее одного атома азота. Нитриды неметаллов — соединения с бором, с алюминием, с кремнием — известны как твердые полимерные вещества с температурой плавления выше 2000 градусов; они являются либо диэлектриков, либо полупроводниками.
Топология атома азота — оригинальная; об этом говорит его петлевая валентность: он присоединяет к себе нечетное количество атомов водорода, а именно три. Номинальная длина шнура исходного тора атома составляет 25 700 эфирных шариков; это относительно длинный шнур, и поэтому деформация тора идет не по пути складывания его вдвое, а —втрое: сначала окружность тора прогибается с трех сторон, затем образовавшиеся три выступа вытягиваются в лучи (лепестки), и на их концах возникают петли; так формируется трехлепестковый атом азота. Если проследить за топологией одиночного атома дальше, то можно отметить, что лепестки изогнутся в одну сторону и сойдутся вместе, уткнувшись вершинами петель друг в друга; атом приобретет грейферную форму.
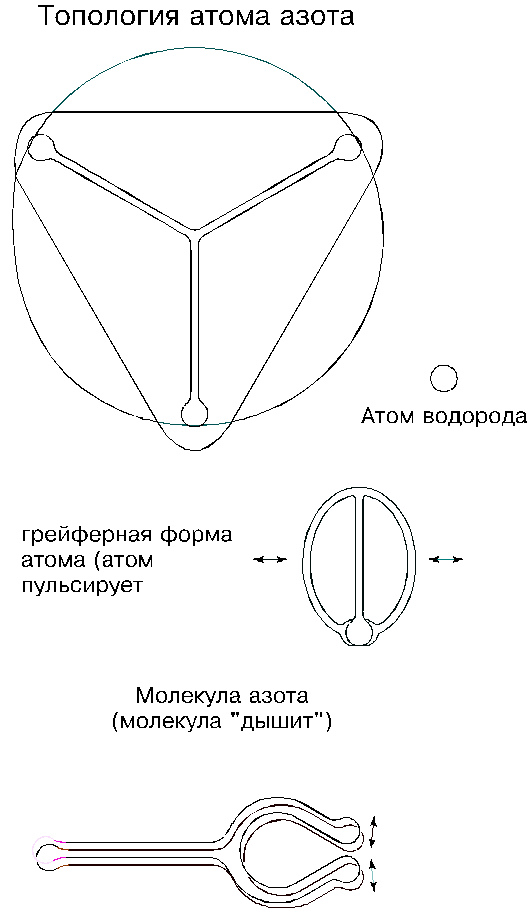
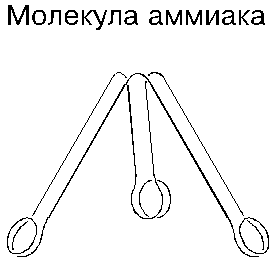
Но скорее всего, до этой грейферной формы дело не дойдет: трехлепестковые атомы при случайных столкновениях будут образовывать двухатомные молекулы. В молекуле азота три петли одного атома прилипают к таким же трем петлям другого; слипаются также их лучи, так как они представляют собой желоба. Оценивая силу сцепления атомов в молекуле азота, можно сказать, что она очень большая; и для того, чтобы разорвать молекулу, нужно приложить огромное усилие.
Молекула могла бы быть вообще нерасторжимой, если бы не два обстоятельства. Первое: размеры атомов в молекуле — не одинаковые, и поэтому их взаимное прилегание — далеко не идеальное; если и встречаются идеальные пары, то они — большая редкость, и у них судьба — жить на пару почти вечно. Второе: спаренные лепестки молекулы испытывают взаимное влечение, и два из них попытаются максимально сблизиться между собой, но им будет противостоять упругость шнуров; борьба этих сил породит неустойчивость в виде порхания спаренных лепестков; колебания отдельных лепестков определяются их индивидуальными характеристиками, и поэтому лепестки в паре будут колебаться невпопад — это еще больше ослабит молекулу.
Порхания спаренных лепестков порождают вокруг молекулы стоячее тепловое поле, и это поле делает молекулу пушистой. Колеблются не только сблизившиеся лепестки, но и оставшийся одиночный, хотя в меньшей степени; и он будет дополнительно раскачивать тепловое поле. Отсюда, азот — газ.
Петлевые соединения атомов азота с атомами других химических элементов хорошо иллюстрируются на примере аммиака: атомы водорода прилипают в нем к присасывающим сторонам петель атома азота, “грейфер” при этом распускается и приобретает вид трехгранной пирамиды, а точнее сказать — три лепестка молекулы с прилипшими на концах водородными колечками расходятся так, что образуют между собой углы порядка 100 градусов. Говорить о том, что эти углы равны точно ста семи градусам, было бы не совсем правильно: учитывая то, что отогнутые лепестки молекулы аммиака не могут в нормальных условиях не колебаться, углы эти имеют переменные значения. Указанные колебания, очевидно, усиливают тепловое поле молекулы, создаваемое в основном атомами водорода; поэтому аммиак — тоже газ. Подчеркнем, что во всех петлевых соединениях азот всегда трехвалентен.
Соединения с помощью желобов атомы азота могут образовывать со всеми металлами и теми неметаллами, которые имеют свои открытые присасывающие желоба. Особняком в этом ряду стоит нитрид лития, который не требует для своего образования специальных условий. Атомы лития легко проникают внутрь “грейфера” атома азота и прилипают там своими желобами и желобами лепестков азота, у которых присасывающие стороны обращены вовнутрь; при этом лепестки расходятся, давая возможность атомам лития слипнуться между собой в центре. Длины лепестка хватает почти на весь присасывающий контур атома лития. В раскрытом виде три присасывающих желоба атома азота могут присоединить к себе атомы других элементов в разном количественном и дробном соотношении. В этом случае азот выступает в роли клея наподобие углерода и способствует упрочнению материалов: склеенные азотом металлы повышают свою твердость и тугоплавкость, сохраняя свои металлические свойства.
Бесцветность азота объясняется опять же тем, что лепестки его атомов колеблются на частотах, не регистрируемых рецепторами человеческого глаза.
Топология атома азота позволяет объяснить такую особенность азотных соединений, что в результате их переподсоединений может выделяться огромное количество тепла, а иногда такой процесс идет со взрывом. Молекулы с участием азота могут представлять собой либо пространственные конструкции, либо сугубо плоские; пространственные, да еще возбужденные молекулы вместе со своими тепловыми полями занимают очень большой объем, а плоские, наоборот, сравнительно малый. Поэтому, если молекуле представится возможность преобразоваться из пространственной в плоскую, то она сделает это с большим желанием: ее потенциальная энергия в этом случае перейдет в кинетическую; выделившееся тепло побудит соседние молекулы сделать то же самое; те, в свою очередь, подтолкнут другие молекулы, и процесс примет цепной характер в виде взрыва.
4.8. Кислород
Восьмой по счету химический элемент таблицы Менделеева — кислород; его атомная масса равна 15,999. Он — самый распространенный на Земле элемент; в атмосфере его 21 процент, в твердой оболочке Земли — 47 процентов; в океанах — 86 процентов.
В нормальных условиях кислород — газ; температура кипения сжиженного кислорода равна минус 182,9 градуса Цельсия, а температура перехода из твердого состояния в жидкое — минус 218,7 градуса. В воздухе атмосферы атомы кислорода объединяются в молекулы; по два атома в каждой. Известна аллотропическая модификация кислорода — озон, молекула которого состоит из трех атомов. Озон возникает при воздействии ультрафиолетового излучения и при проскакивании электрического разряда (молнии).
Кислород химически очень активен; по своей активности он уступает только фтору. Он соединяется практически со всеми элементами, исключая инертные газы. В соединениях с металлами он проявляет переменную и даже дробную валентность. Почти все реакции с участием кислорода относятся к типу экзотермических, то есть происходят с выделением тепла или даже света, а соединение с водородом происходит даже в форме взрыва. Еще более активен озон.
Из соединений кислорода наиболее известна вода, молекула которой состоит из одного атома кислорода и двух атомов водорода; водород разнесен в молекуле на угол 104,5 градуса. Вода, больше известная как жидкость, входит основной составной частью в минералы, где предстает уже в твердом виде. Жидкая вода закипает при 100 градусах и замерзает при нуле градусов по Цельсию. В жидком состоянии вода имеет малую вязкость и большую теплоемкость
. Известно, что в сплошной массе молекулы воды могут диссоциировать, то есть распадаться на составляющие атомы. Вода — хороший растворитель.С углеродом кислород образует углекислый газ, молекула которого содержит один атом углерода и два атома кислорода; при недостатке кислорода образуется угарный газ, молекула которого содержит уже по одному атому того или другого элемента.
Самую большую химическую активность кислород проявляет в составе кислот. Он объединяется в них с азотом, серой, фосфором и другими элементами; замыкают молекулы кислот атомы водорода. Водные растворы кислот разъедают практически все металлы. Атомарный кислород тоже разъедает металлы, образуя окислы, но действует менее активно.
Топология атома кислорода продолжает ту же треугольную тему, что была начата атомом азота: исходное кольцо-тор деформируется с трех сторон, выступы вытягиваются, шнуры сближаются; и заканчивается первый этап образования трехлучевой звезды с петлями на концах лучей. У азота такая звезда некоторое время сохраняется плоской и в такой форме успевает за это время найти себе подобную и присосаться к ней, образуя двухатомную молекулу.
Размеры исходного тора атома кислорода несколько больше: номинальная длина его шнура составляет 29 400 эфирных шариков, то есть на 3700 шариков длиннее, чем у азота; поэтому возникает некоторая коррекция топологии атома. Одновременно с вытягиванием концов звезды происходит их сближение и закручивание; сблизившиеся любые два лепестка образуют между собой еще одну, вторичную петлю, а оставшийся в одиночестве третий лепесток заворачивается, создавая внешний присасывающий желоб, и накрывает ее своей петлей; это — второй промежуточный этап топологии атома кислорода.
На третьем, последнем этапе сблизившиеся два лепестка сначала поворачиваются друг к другу “лицом”, то есть присасывающими сторонами, слипаются насколько это возможно, а затем загибаются и упираются макушками своих петель в присасывающий желоб завернувшегося одиночного лепестка; на этом топология одиночного атома кислорода завершается.
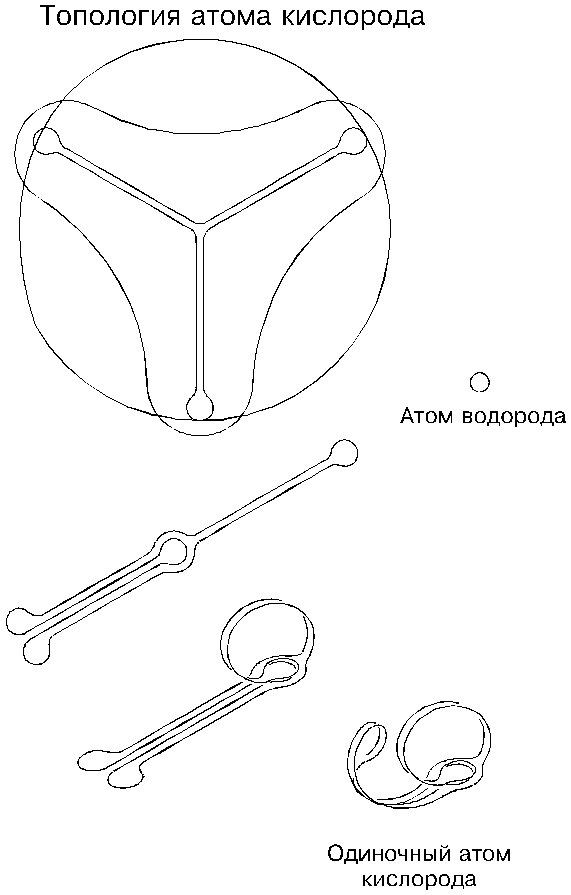
Что же в конце концов получилось? А получилась в некотором роде уникальная форма атома: своим контурным, открытым наружу присасывающим желобом он похож на атом металла, но все же это — не металл; все его загнутые части оказываются напряженными, и по этой причине они неустойчивы, и атом пульсирует, создавая вокруг себя стоячее тепловое поле; значит, он — пушист, и эта пушистость не позволяет ему соединиться с такими же атомами, как он сам, и образовать металлическое тело. Если же он все же соединится с ними, например при образовании молекул, то происходит это с разгибом спаренных лепестков и с разворотом их петель, то есть с разрывом замкнутого контурного желоба. Получается так, что, пока атом кислорода находится в одиночестве, он — металл, а когда соединяется с другими атомами, то — уже не металл.
Молекула кислорода состоит из двух атомов, объединившихся путем слипания петель спаренных лепестков и примыкающих к ним присасывающих желобов. Молекула также пушиста: слипанию атомов в ней противодействуют их закрученные как пружины одиночные лепестки, и это противодействие порождает ее пульсацию, выражающуюся в том, что слипшиеся парные лепестки будут периодически выдвигаться из молекулы — удлиняясь, и убираться внутрь — укорачиваясь.
Соединение кислорода с водородом образует воду: в результате сильного теплового воздействия молекула кислорода распадается на атомы; их освободившиеся петли, не успев развернуться и слипнуться между собой, тотчас заполняются колечками атомов водорода; возникает знаменитая молекула аш-два-о. Бывшие ранее спаренными лепестки атома кислорода после подсоединения к их петлям атомов водорода расходятся под некоторым углом и успокаиваются. Успокаивается и вся молекула: несмотря на то, что присоединившиеся атомы водорода создают дополнительную пушистость, в целом пульсация молекулы воды оказывается несколько приглушенной, и в нормальных условиях она уже не является газообразной, а переходит в жидкость.
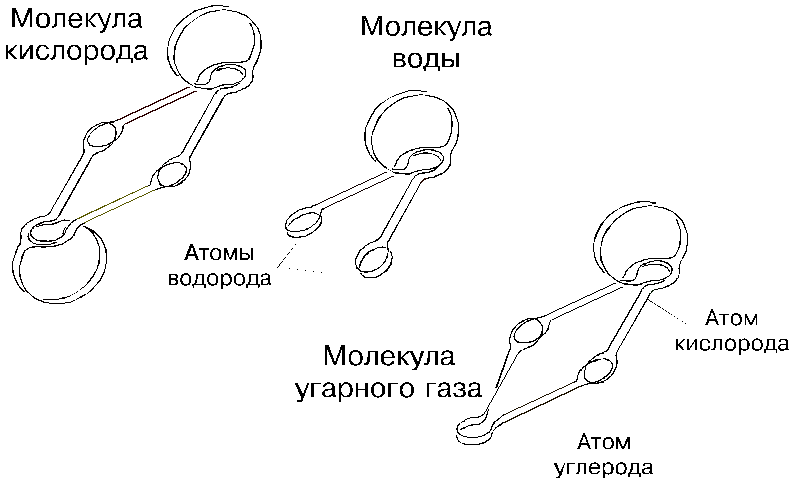
Вода отличается от других жидкостей многими своими свойствами, и одно из них — постоянство вязкости при изменении температуры. Если молекулы других жидкостей, ускоряя свои тепловые движения, уменьшают взаимный контакт и становятся как бы менее привязанными друг к другу, то молекулы воды сохраняют взаимную связь практически постоянной; это объясняется тем, что их подвижность вызвана в основном пушистостью атомов водорода и загнутых одиночных лепестков, а она очень мало зависит от температуры. Конечно, общие тепловые колебания молекул могут сделать их пушистыми до газообразности (это происходит при кипении) или, наоборот, уменьшить подвижность до прекращения взаимного скольжения (явление образования льда), но в интервале между этими состояниями связи между молекул между собой сохраняются практически постоянными.
Вода отличается еще очень большой своей теплоемкостью. У молекулы воды можно выделить следующие поглотители тепловых движений: это — загнутый в кольцо одиночный лепесток и два отогнутых (прямых) лепестка с водородными атомами на концах. Пульсирующее кольцо загнутого лепестка может иметь широкий диапазон амплитуд своих колебаний, то есть может накапливать большую энергию. Но основными поглотителями тепловых движений все же являются вытянутые лепестки; они представляют собой консоли с массами водородных атомов, отнесенными на их концы; момент инерции этих консолей — очень большой. Поглощая энергию внешних ударов, вытянутые лепестки лишь незначительно увеличивают амплитуду своих колебаний; и для того, чтобы раскачать их основательно, нужно приложить к ним много внешней энергии.
Объяснение других свойств воды и кислорода, таких как способности растворять и окислять, кроется в накопительстве атомом кислорода и молекулой воды в целом большего количества электронов. Атом имеет очень длинные присасывающие желоба, обращенные наружу; на таких желобах может скапливаться очень много электронов. У молекулы воды дополнительные присасывающие наружные желоба возникают по контурам атомов водорода. Поэтому молекулу воды можно считать накопителем электронов.
Большое скопление электронов является одной из причин диссоциации молекул воды: электроны, проникая в щели под атомами водорода, ослабляют их связи с атомами кислорода вплоть до их отделения. Другой причиной являются тепловые колебания консольных лепестков: молекула воды размахивает ими как деревья своими ветвями в сильный ветер; в общей массе жидкости молекулы лупят друг друга этими лепестками, как молотками; при этом атомы водорода на концах чувствуют себя не очень уютно.
Точно также происходит растворение в воде твердых веществ. Сначала, уткнувшись своим консольным лепестком в атом (или молекулу) твердого вещества, молекула воды производит инъекцию электронов (шприцует их); электроны ослабляют межатомные связи вещества; а затем ударами своих лепестков, как дубинами, вода срывает непрочные атомы и молекулы со своих мест и поглощает их. Растворение в воде кислот, содержащих кислород, сопровождается диссоциацией, то есть частичным или полным отделением атомов водорода.
Приблизительно также происходит окисление металлов. Сначала инъекцией электронов и ударами своих лепестков атомы кислорода, растворенные в воде, ослабляют крепление поверхностных атомов металла, а затем обволакивают их своими лепестками как щупальцами; при этом присасывающие желоба кислорода накладываются на присасывающие желоба металла и нейтрализуют их. Точно также ведет себя по отношению к металлу кислород, находящийся в составе кислот. Соединение их между собой происходит с помощью желобов, поэтому их количественное соотношение определяется соотношением длин желобов, и оно может быть некратным; отсюда — переменная и дробная валентность.
Обволакивание атомов различных химических элементов с помощью щупальцев (лепестков) воды способствует успокоению пульсаций ее молекул: их колебания амортизируются соседними атомами. Лишившись своей подвижности, молекулы воды становятся средствами скрепления других атомов, то есть клеем как азот, как углерод, как бор или бериллий в подобной роли. Поэтому в минералах оказывается так много воды.
Среди петлевых соединений кислорода можно выделит образование угарного и углекислого газов. При недостатке кислорода его атомы в первую очередь соединяются своими петлями с выкрученными петлями атомов углерода; его нормально замкнутые петли при этом не раскрываются; это — угарный газ. При избытке кислорода и при высокой температуре замкнутые петли углерода также раскрываются и соединяются с петлями других атомов кислорода; возникает углекислый газ. В указанных соединениях напряженность атомов углерода и кислорода уменьшается, то есть уменьшается их потенциальная энергия, и соответственно увеличивается кинетическая, тепловая энергия. Повышение температуры сопровождается выделением света: светятся атомы углерода.
Из трех состояний кислорода: атомарного, молекулярного и озонного, — последнее — наиболее активное. Если у одиночного атома кислорода и молекулы парные лепестки замкнуты своими петлями и не совсем готовы для присоединения к другим атомам, то у озона они находятся в непрочном соединении между собой и легко раскрываются.
4.9. Фтор
Фтор — девятый по счету химический элемент таблицы Менделеева, его атомная масса равна 18,998. Он представляет собой бледно-желтый газ с температурой плавления минус 219,6 и кипения минус 188,1 градусов Цельсия.
Фтор — самый сильный окислитель, он окисляет даже кислород; его химическая активность настолько высока, что он реагирует почти со всеми веществами, за исключением инертных газов: гелия, аргона, неона; при нормальных условиях он не взаимодействует также с азотом и с углеродом в алмазной модификации. При реакциях с его участием выделяется много тепла, иногда это происходит в виде взрыва.
Странное дело, углефторовые соединения — фторопласт и тефлон — отличаются, наоборот, поразительной химической стойкостью: их не берет даже царская водка — концентрированная смесь азотной и соляной кислот. Инертностью отличаются также фреоны (хладоны) — насыщенные углеводороды, в которых водород заменен на фтор и хлор; фреоны являются газами и используются в качестве хладоагентов для холодильников; их температура кипения — около минус 30 градусов Цельсия.
Из других соединений широко известны плавиковая кислота, молекула которой состоит из одного атома углерода и одного атома фтора, и природные минералы: флюорит, плавиковый шпат и другие. Свободный фтор в природе не встречается.
Топология атома фтора завершает треугольную тему. После формирования из исходного тора трехлучевой звезды процесс дальнейшего развития атома выбирает иное, чем у азота и кислорода, направление: два лепестка (луча) успевают сблизиться своими концами, на которых расположены присасывающие петли, раньше, чем, сойтись своими основаниями; сблизившиеся петли разворачиваются и слипаются, нейтрализуя друг друга; слипшиеся петли изгибают дугой свои спаренные шнуры и ловят макушками желоб оставшегося одиночного лепестка. В законченном виде атом фтора напоминает летящего гуся с крыльями из завернувшихся лепестков и с вытянутой шеей последнего третьего из них; петля на конце третьего лепестка ассоциируется с клювом, готовым ущипнуть. Отличие от принятого образа будет состоять, скорее всего, в том, что голова гуся не вытянута в струнку, а мечется из стороны в сторону. Новое, фторовское направление в формировании атома обусловлено удлинением лепестков: у фтора они длиннее приблизительно на 1000 эфирных шариков, чем у кислорода, и на 1500, чем у азота, а вся длина шнура атома фтора составляет 35 000 шариков.
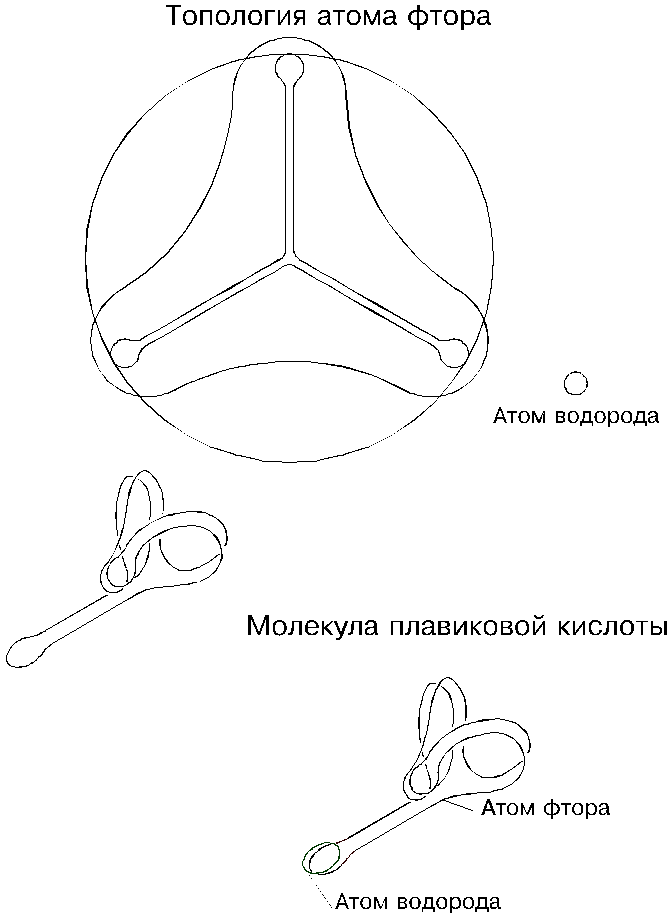
Повышенная активность атома фтора объясняется тем, что он, во-первых, может накапливать на своих присасывающих желобах электронов больше, чем даже атомы кислорода (за счет более длинных желобов, на которых может скопится более 17 000 электронов), а во-вторых, весь этот запас электронов приходится не на два щупальца как у кислорода, а на один клюв. Имея очень длинную шею, атом фтора может дотянуться до самых удаленных слипшихся участков в молекулах других веществ, выбросить на них большую порцию электронов, ослабив тем самым их связи, прилипнуть своей петлей или своим желобом к столкнувшимся атомам или молекулам и образовать новое соединение. Поэтому перед агрессией фтора не может устоять практически ни одно вещество, и поэтому оно называется разрушителем (по гречески “фторос” — разрушение). К слову, разъединительное влияние электронов сказывается и на соединениях самого фтора: если пропустить через плавиковую кислоту электрические разряды, она распадается на водород и фтор.
С другой стороны, удивительную химическую инертность фторопласта и тефлона можно объяснить тем, что в соединениях атомов фтора с атомами углерода нейтрализуются (закрываются) не только присасывающие стороны их петель, но и их присасывающие желоба: и у того и у другого длина каждого из желобов составляет приблизительно 5000 эфирных шариков, поэтому они смыкаются без остатка. Между собой молекулы тетрафторэтилена, образующие фторопласт и тефлон, контактируют отдельными точками, в частности боковушками петель; эти контакты не очень прочны.
С азотом фтор не соединяется по простой причине: молекула азота, как мы знаем, полностью закрыта, и атом фтора бессилен подобрать к ней ключи; к тому же молекула не очень боится его электронных инъекций: у нее у самой имеется большое количество электронов. Также нам должно быть понятно то, что атом фтора не способен разрушить кристаллы алмаза: они так крепко сшиты, что не имеют щелей и прорех, через которые он мог бы проникнуть своим клювом; самое большое, что способен сделать фтор с алмазом, так это прилипнуть к нему, но и это возможно только в том случае, если поверхностные связи кристалла случайно окажутся незавершенными.
В качестве хладоагентов соединения фтора применяют потому, что они имеют очень удобную температуру кипения: давлением компрессора и охлаждением их легко превращать в жидкость, а она, испаряясь, отбирает тепло. К тому же теплоемкость фтора, атом которого имеет консоль, то есть длинную шею, довольно большая. Она — эта теплоемкость — является причиной того, что все реакции с участием фтора идут с выделением тепла: успокаиваясь в соединениях с другими атомами, фтор передает вновь образованным молекулам все свои тепловые движения.
4.10. Неон
Инертный газ неон занимает в таблице Менделеева десятую позицию: атомная масса неона равна 20,179. Об инертных газах известно только одно: они не способны вступать в химическую реакцию вообще. С одним из таких газов — с гелием — мы уже познакомились: неон — второй из них.
Топология атомов неона открывает новую страницу. Забегая вперед, скажем, что атом неона представляет собой два спаренных атома гелия; и такими же спаренными будут все атомы третьего периода. Отсюда можно сделать вывод о том, что в таблице Менделеева неону больше подходит место в третьем периоде перед натрием. Впрочем, подобную передвижку следовало бы сделать со всеми химическими элементами инертных газов: каждый из них лучше было бы сместить в следующий период и поставить перед первым щелочным металлом.
Исходное кольцо-тор будущего атома неона деформируется уже с четырех сторон; этому способствует длина кольца — она составляет 37 100 эфирных шариков у номинального атома, что на 2 100 шариков больше, чем у фтора. Шнуры выступов сближаются; сами выступы вытягиваются и образуют четырехлучевую звезду; на концах лучей возникают петли. Далее петли попарно сближаются, и фигура приобретает двухчастный вид; полуфигуры разворачиваются на 180 градусов, и в центре между ними возникает перехлест. Столкнувшиеся макушками петли делают полуповорот в разные стороны и взаимно сдвигаются, образуя гелиевые накладки. Завершается топология атома неона тем, что круглые полуфигуры, стягиваемые наружными присасывающими желобами, чуть-чуть поворачиваются вокруг своих осей и успокаиваются, обращенные петлевыми накладками в одну сторону; присасывающие желоба при этом укорачиваются почти до нуля.
Возникший атом неона пульсирует точно также, как атом гелия; поэтому он такой же пушистый: его температура кипения равна минус 245,9 градуса Цельсия.
Инертность атома неона объясняется тем, что у него практически нет обращенных наружу присасывающих желобов и нет открытых присасывающих сторон петель.
4.11. Натрий
Топология атома первого щелочного металла третьего периода таблицы Менделеева — натрия развивает четырехлучевое направление неона: вместо гелиевых накладок полуфигуры атома натрия образуют литие-бериллиевские сердечки. Они стали возможными потому, что длина шнура атома натрия на 5200 эфирных шариков длиннее, чем у атома неона, и составляет 42 300 шариков.
И так далее.